Ремиттирующий серонегативный симметричный синовит с мягким отеком
Паранеопластические синдромы развиваются редко, но могут иметь огромное влияние на диагностику и исход онкологических заболеваний. Ревматолог должен быть знаком с несколькими типичными костно-мышечными манифестациями злокачественных новообразований, чтобы иметь возможность рано постановить диагноз и своевременно начать противоопухолевое лечение. В данном обзоре описываются характерные черты различных паранеопластических артритов и васкулитов, ассоциированного с опухолями миозита, гипертрофической остеоартропатии и опухоль-индуцированной остеомаляции. В дополнение к этому обсуждаются текущие представления о механизма, лежащих в основе данных синдромов.
1. Введение
Ревматические симптомы могут быть связаны со злокачественными заболеваниями различными способами. Опухоли могут возникать из мезенхимальных клеток костей, хрящей, мышц или соединительной ткани. Также костно-мышечная система может подвергнуться инвазии метастазами опухолей других локализаций или инфильтрации клетками гематологических опухолей. Кроме того, некоторые варианты противоопухолевой терапии могут вызывать множество ревматических проявлений. Особый интерес для ревматолога представляют скелетно-мышечные симптомы, вызванные ингибиторами ароматазы, БЦЖ-индуцированный реактивный артрит при карциноме мочевого пузыря, а в последнее время к этому списку также добавились различные аутоиммунные проявления и симптомы, связанные с лечением ингибиторами контрольных точек иммунного ответа. Этот обзор фокусируется на третьем возможном механизме, который связывает рост злокачественных клеток и аутоиммунитет: паранеопластический ревматический синдром.
Паранеопластические синдромы редки, но имеют характерные черты, которые могут быть чрезвычайно значимы для раннего выявления и терапии скрытого злокачественного заболевания. Они не вызываются напрямую опухолью или метастазами, но опосредуются растворимыми факторами, такими как гормоны и цитокины, или гуморальными и клеточными иммунными механизмами, направленными против опухолевых клеток. Поэтому клинические проявления паранеопластических синдромов могут наблюдаться в удалении от основной опухоли и включать поражение суставов, фасций, мышц, сосудов и костей.
Чтобы классифицировать ревматическое заболевание как истинно паранеопластическое, должна быть продемонстрирована причинная связь между злокачественной опухолью и костно-мышечной патологией. Для обоснования подобной связи и отличия от простого совпадения более 50 лет назад были предложены критерии Брэдфорда Хилла. В случае паранеоплазии, помимо силы и специфичности ассоциации между диагнозом опухоли и ревматическими симптомами, их временные отношения являются критическим вопросом. Синдром обычно считается паранеопластическим, если костно-мышечная манифестация возникла одновременно или не более, чем за год (в некоторых исследованиях — два года) до обнаружения злокачественного новообразования. Лучшее доказательство причинности устанавливается ретроспективно, в том случае, когда возможно полностью устранить опухоль, а ревматические симптомы претерпевают полную ремиссию.
Исходя из этих соображений будет представлен обзор клинических характеристик и текущего патофизиологического понимания различных форм паранеопластического полиартрита, миозита, ассоциированного с раковыми опухолями, паранеопластического васкулита, гипертрофической остеоартропатии и остеомаляции, вызванной опухолью. Для других ревматических расстройств, таких как ревматическая полимиалгия или болезнь Стилла взрослых, потенциальная связь с лежащим в основе злокачественным заболеванием была признана недостаточно сильной, чтобы отнести их к истинным паранеоплазиям.
2. Паранеопластический артрит (ПА)
В прошлом было описано множество клинических случаев, а также их серий, в которых возникший de novo синовит с активным воспалением предшествовал или приводил к выявлению лежащей в основе злокачественной опухоли. Недавно была описана группа из 65 пациентов с ПА и их клинические и демографические характеристики сравнили с таковыми у 50 пациентов с впервые выявленным ревматоидным артритом (РА). Средний возраст начала паранеопластического артрита составил 50 лет, преобладание мужчин составило 65 %, что резко контрастирует с РA. Синовит обычно начинается как острый асимметричный (91 %) поли- (34 %), олиго- (48 %) или моноартрит (18 %) с высоким уровнем лабораторных маркеров воспаления. Диагностическая дилемма при ПА возникает из-за того, что 23 % пациентов имеют положительный результат исследования на ревматоидный фактор и 11 % на антитела против цитруллинированных белков (АЦЦП). Поэтому в отдельных случаях диагноз затруднен и часто единственным клиническим намеком на необходимость поиска опухоли остается несколько атипичное вовлечение суставов и плохой ответ на стандартную противоревматическую терапию, особенно на кортикостероиды. До сих пор не была выдвинута последовательная теория, способная объяснить патогенез. Только в одном случае рака почки ученым удалось определить клоны Т-клеток с идентичными реаранжировками рецепторов среди инфильтрировавших опухоль иммунных клеток и в синовиальных тканях, что указывает на кросс-реактивность злокачественных клеток и синовиальных антигенов при ПА. Недавно цитруллинированный виментин был признан важным опухолевым антигеном злокачественных опухолей эпителиального происхождения. Также был определен Т-клеточный иммунный ответ против раковых клеток, экспрессирующих цитруллинированный виментин, который запускал противоопухолевый ответ. Следовательно, по крайней мере некоторые формы ПА, особенно те, которые ассоциированы с положительным тестом на АЦЦП, могут быть основаны на иммунных ответах против цитруллинированных опухолевых антигенов.
3. Пальмарный (ладонный) фасциит и синдром полиартрита (Palmar fasciitis and polyarthritis syndrome, PFPAS)
Распознавание возможной паранеоплазии у пациента происходит проще, когда в дополнение к обычному синовиту есть другие характерные особенности. Это относится к PFPAS, при котором воспаление ладонной и/или подошвенной фасции приводит к очень отчетливым клиническим проявлениям. PFPAS характеризуется остро возникшим симметричным диффузным болезненным отеком обеих рук, вызванным полиартритом пальцев и запястья в сочетании с ладонным фасциитом. Этот синдром проявляется заметным утолщением и уплотнением тканей ладони и быстро прогрессирующими сгибательными контрактурами (Рис.1). Пальпаторная картина лучше всего описывается термином «деревянные руки» (“woody hands”). Также обнаруживаются артриты и других суставов, но они обычно протекают мягче; вовлечение подошв происходит примерно в 20 % случаев. В общей сложности в литературе можно найти около сотни описаний клинических случаев данного паранеопластического синдрома, причем более половины из них связаны с аденокарциномой яичников или другими урогенитальными опухолями. Часто онкомаркеры CA125 и CA19-9 оказываются положительными, что является диагностической подсказкой. Патогенетические механизмы не определены, однако неоднократно предполагалась потенциальная роль фактора роста соединительной ткани (connective tissue growth factor, CTGF) в развитии PFPAS. Кроме того, существует единичный отчет об индукции PFPAS при лечении ингибитором металлопротеаз.
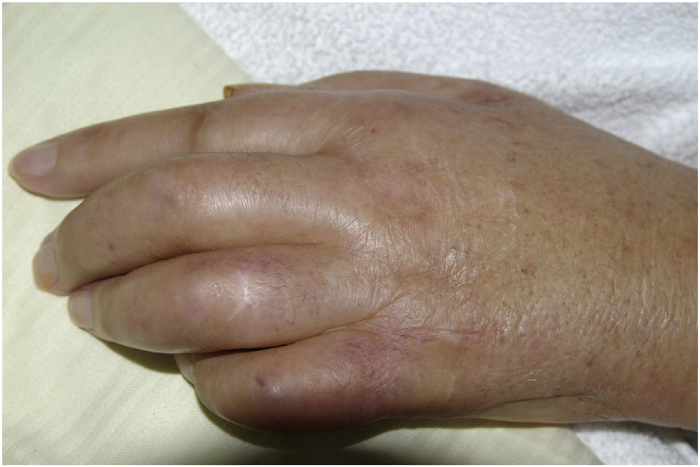
Рисунок 1. Сгибательная контрактура из-за ладонного фасциита у пациента с PFPAS и карциномой яичников.
4. Ремиттирующий серонегативный симметричный синовит с мягкими отеками
Этот артрит, начинающийся в пожилом возрасте, характеризуется симметричным отеком тыльной поверхности кистей и стоп, обычно не чувствителен к кортикостероидам и имеет хороший общий прогноз. Однако в объединенных данных из различных европейских и американских исследований частота злокачественных новообразований у таких пациентов составила 31 %. В японской группе из 33 пациентов с данным синдромом, у восьми развились раковые заболевания в течение двух лет от начала артрита. У этих пациентов наблюдалось значительное повышение уровня металлопротеиназы 3 в сыворотке. В целом, у любого пациента серонегативный симметричный синовит с мягкими отеками и плохим ответом на кортикостероиды следует считать красным флагом и склоняться к поиску скрытой злокачественной опухоли.
5. Панкреатический панникулит и полиартрит (ППП)
Полиартрит в сочетании с панникулитом, напоминающим узловатую эритему, неоднократно описывался у пациентов с панкреатитом и высоким уровнем сывороточной липазы. Такие же проявления можно наблюдать и при ацинарно-клеточном раке поджелудочной железы, который также приводит к чрезвычайно высоким концентрациям липазы в кровотоке (Рис. 2). Это вызывает обширные некротические поражения подкожной жировой клетчатки с окружающей воспалительной реакцией. Полиартрит чаще всего поражает голеностопные, коленные, лучезапястные и пястно-фаланговые суставы. В более чем 130 публикациях ППП ассоциируется с неблагоприятным прогнозом.
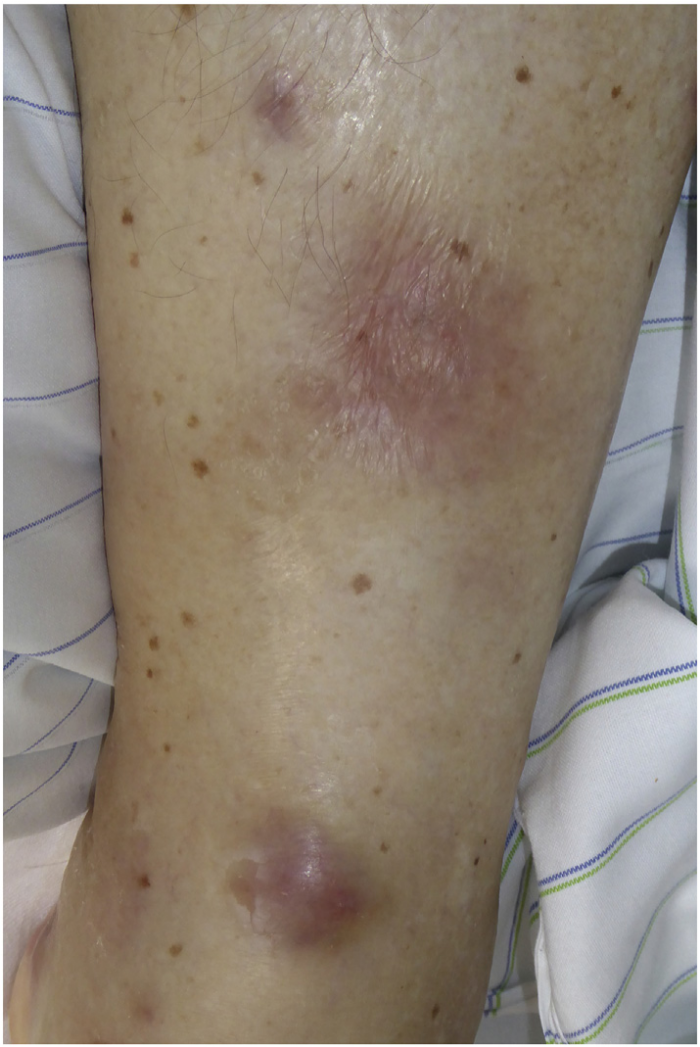
Рисунок 2. Узелковое воспаление подкожной клетчатки у пациента с панкреатическим панникулитом и полиартритом и ацинарно-клеточным раком поджелудочной железы.
6. Паранеопластический васкулит
Хотя для различных васкулитов сообщалось о временной связи со злокачественными заболеваниями, наиболее распространенной манифестацией является кожный лейкоцитокластический васкулит. Гематологические выступают причиной этого васкулита в более чем половине случаев, при этом наиболее частыми диагнозами являются миелодиспластический синдром и неходжкинские лимфомы. Среди солидных опухолей наиболее распространенными причинами паранеопластического васкулита являются рак легких, молочной железы и урогенитальные опухоли. В недавнем ретроспективном анализе 421 взрослого пациента с клинически явным или подтвержденным биопсией кожным васкулитом 16 (3,8 %) были паранеопластическими (9 гематологических, 7 солидных злокачественных новообразований). У четырех были дополнительные суставные симптомы, у двоих из них были желудочно-кишечные поражения или нефропатия. В таком контексте представляется интересным, что у взрослых пациентов с гистологически подтвержденной пурпурой Шенлейна-Геноха неоднократно были диагностированы злокачественные опухоли. При этом в качестве возможного патогенетического механизма предлагается отложение иммунных комплексов, содержащих опухолевые антигены и IgA.
7. Миозит, ассоциированный со злокачественными опухолями (Cancer-associated myositis, CAM)
В многочисленных эпидемиологических исследованиях проанализирована взаимосвязь между воспалительными заболеваниями мышц и злокачественными новообразованиями. Мета-анализ подтвердил, что дерматомиозит связан с неоплазией примерно в 24 % случаев. Стандартизованное отношение заболеваемости (SIR) варьирует от 3,8 до 7,7. Для полимиозитов ассоциация значительно слабее (SIR 1,7–2,2) и в случае клинических признаков overlap-синдрома при сочетании с другими заболеваниями соединительной ткани (например, интерстициальное поражение легких, феномен Рейно) риск наличия опухоли не возрастает. Аналогичным образом, наличие различных аутоантител, указывающих на заболевание соединительной ткани (таких как антисинтетазные, анти-Ro52 или антитела, ассоциированные с системным склерозом), снижает риск развития ассоциированного с опухолями миозита. Однако существует один тип аутоантител, четко связанный с данным миозитом. Сывороточные аутоантитела к внутриклеточному белку с массой 155 кДа (anti-p155) были первоначально описаны при ювенильном дерматомиозите, но также обнаружены у одного из шести взрослых пациентов с дерматомиозитом. Из этих взрослых пациентов с анти-p155 антителами у 65 % злокачественное заболевание развилось в течение трех лет после начала миозита. Эта связь была подтверждена в ряде других групп с миозитом. В дальнейшем аутоантиген p155 идентифицировали как промежуточный фактор транскрипции-1γ (TIF-1γ), член семейства белков, участвующих в различных функциях (убиквитинирование опухолевого супрессора р53, апоптоз), связанных с канцерогенезом. Таким образом, противоопухолевый иммунный ответ может приводить к образованию антител против TIF-1γ и способствовать развитию ассоциированного с опухолями миозита путем перекрестной реакции с тканевыми антигенами мышц. Еще одно аутоантитело (анти-MJ), которое связывает белок ядерной матрицы NXP2, было описано у пациентов с CAM, но число пациентов все еще слишком мало, чтобы уверенно делать выводы.
8. Гипертрофическая легочная остеоартропатия (ГЛО)
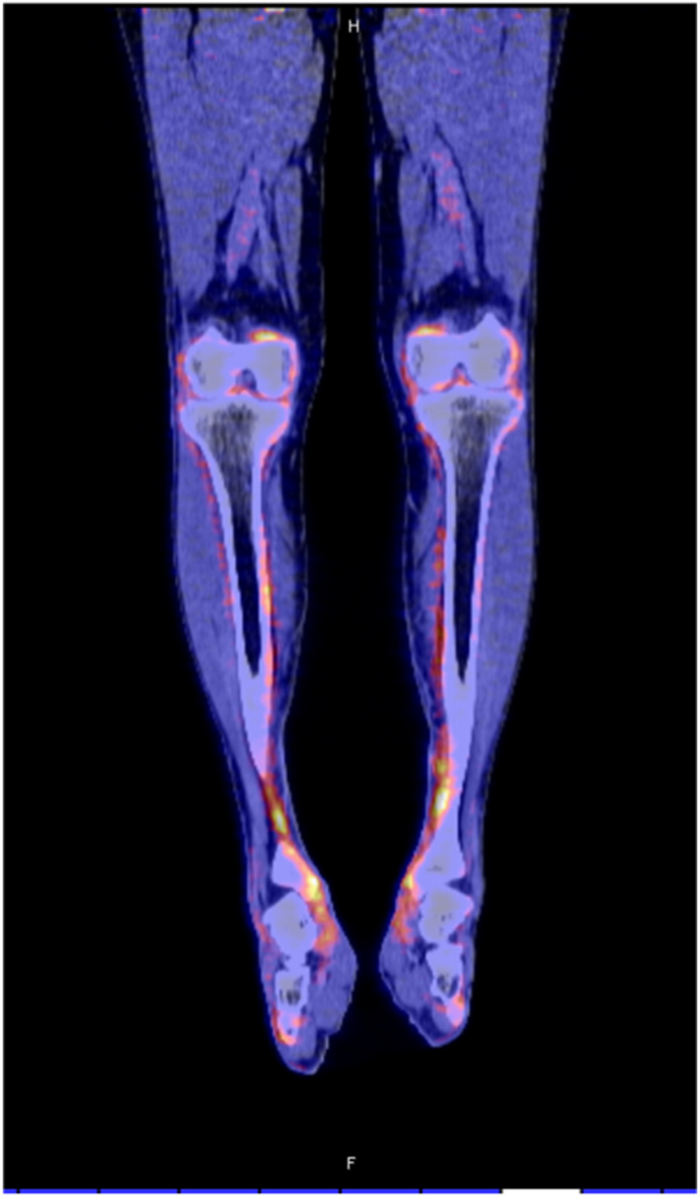
ГЛО, или синдром Мари-Бламбергера, представляет собой классическую костно-мышечную паранеоплазию и часто описывается в ревматологической литературе. Синдром характеризуется двумя отличительными симптомами: одним из них является утолщение дистальных фаланг пальцев рук и/или пальцев ног в виде барабанных палочек, а другой — воспалительный пролиферативный периостит, вызывающий костные и суставные боли, а иногда и синовит с выпотом в полости сустава. Преобладающими локализациями являются большеберцовая и малоберцовая кости, коленные и голеностопные суставы (Рис. 3). Это периостальное воспаление вызывает активацию остеобластов, что легко обнаруживается благодаря усиленному поглощению контраста при остеосцинтиграфии и оссификации надкостницы вдоль трубчатых костей при обычной рентгенографии. При ретроспективном анализе частота ГЛО при первичном раке легкого была близка к 1 %, однако ГЛО иногда также может возникать и при других типах злокачественных новообразований (преимущественно внутригрудных). Из-за характерной акральной активации фибробластов и периостальной активации остеобластов этот синдром первоначально считался вариантом акромегалии. Сегодня стало ясно, что тромбоцитарный фактор роста (PDGF) или фактор роста эндотелия сосудов (VEGF), продуцируемые опухолевыми клетками, могут способствовать развитию ГЛО.

Рисунок 3. ПЭТ КТ показывает значимое поглощение 18F-флюородеоксиглюкозы вдоль контуры большеберцовой кости у пациента с ГЛО и аденокарциномой бронхов.
9. Опухоль-индуцированная остеомаляция
Паранеопластическая остеомаляция клинически неотличима от других форм остеомаляции с прогрессирующей костной болью, спонтанными переломами, мышечной слабостью и усталостью. Биохимическая картина состоит из гипофосфатемии, гиперфосфатурии, нормального уровня кальция и паратиреоидного гормона, нормального или сниженного уровня кальцитриола и повышенной щелочной фосфатазы. Причиной дисбаланса в фосфатно-кальциевом обмене является значимая потеря фосфата почками из-за высоких концентраций циркулирующего фактора роста фибробластов 23 (FGF23, фосфатонин). FGF23 ингибирует реабсорбцию фосфата в проксимальных канальцах и подавляет дифференцировку остеобластов и минерализацию матрикса в кости. В большинстве случаев FGF23 продуцируется мезенхимальными опухолями (смешанный соединительнотканный вариант), опухолями с другими гистологическими типами (гемангиоперицитома, гигантоклеточная опухоль, остеосаркома) —значительно реже. Из 300 случаев опухоль-индуцированной остеомаляции внутрикостная опухоль была обнаружена в 40 % случаев, в 55 % новообразование было в мягких тканях. Только 8 % опухолей были злокачественными. Успешная локализация и удаление новообразования обычно приводят к полному устранению всех симптомов.
10. Заключение
Костно-мышечные паранеоплазии имеют важное клиническое значение по ряду причин: они часто предшествуют другим клиническим проявлениям новообразований и могут способствовать своевременной диагностике и потенциальному излечению от злокачественного заболевания. После успешного удаления злокачественных клеток паранеопластические симптомы обычно стихают, но повторное появление симптомов со стороны опорно-двигательного аппарата может указывать на рецидив или метастазирование, хотя клинически это не является надежным критерием. Паранеопластические симптомы также могут оказывать значительное влияние на качество жизни, заболеваемость и смертность пациентов с опухолями. В последние годы выяснены некоторые из основных механизмов паранеопластических синдромов, что улучшает наше понимание патогенеза ревматических и неопластических заболеваний.
Источник
Содержание:
«В движении жизнь» – это выражение, вероятно, слышали все. Действительно, для осуществления нормальной жизнедеятельности человеку приходится постоянно перемещать свое тело в пространстве. В ходе эволюции организм обзавелся прекрасными элементами, которые обеспечивают данную функцию на высшем уровне. Эти удивительные части тела – суставы. Все кости человека удивительно прочны и упруги по отдельности, что позволяет им выдерживать колоссальные нагрузки. Соединяясь же воедино, они формируют удивительно подвижный скелет, который позволяет выполнять невероятные движения. Все это достигается благодаря слаженной работе массы суставов.
К сожалению, есть заболевания, в результате прогрессирования которых суставы организма поражаются и теряют свою подвижность. В результате у пациента значительно снижается качество жизни. Ревматоидный артрит – очень актуальная проблема современной ревматологии. Это системное заболевание, поражающее соединительную ткань. В результате его развития у пациента поражаются мелкие суставы по эрозивно-деструктивному типу. Во всем мире от данного заболевания страдает около 60 миллионов пациентов, что составляет до 1% от всей популяции.
Еще более усугубляет всю ситуацию то, что врачи не смогли до настоящего времени определить точную причину развития заболевания. Есть отдельные теории и предположения, но ни одна из них не нашла действительно весомого подтверждения. С течением времени же все симптомы болезни неуклонно усугубляются, постепенно приводя к стойкой утрате нетрудоспособности человеком. Примерно в три раза чаще заболевают женщины. Средний возраст пациента при выявлении заболевания – 30-35 лет.
Причины ревматоидного артрита
В настоящее время есть несколько наиболее вероятных этиологических факторов болезни. Каждая версия имеет свои преимущества и недостатки. В целом же все больше медиков склоняются к тому, что ревматоидный артрит – полифакторное заболевание, которое развивается при комбинировании сразу нескольких причин.
— Генетическая предрасположенность – у пациентов с данным диагнозом установлена предрасположенность к нарушениям активности иммунной системы на генетическом уровне. Уже обнаружены некоторые антигены, наличие которых может приводить к изменению гуморального и клеточного иммунитета вследствие воздействия некоторых инфекций. Также можно проследить повышенную вероятность развития ревматоидного артрита у людей, ближайшие родственники которых также болели ним.
— Инфекционные агенты, способные в результате своих специфических свойств вызывать изменения в иммунитете человека, в результате чего собственные защитные факторы атакуют свою соединительную ткань. На роль этих возбудителей выдвигаются: вирус Эбштейн-Бара, ретровирусы, возбудители краснухи, герпеса, цитомегаловирус, микоплазмы. У врачей есть некоторые доказательства в пользу этой гипотезы:
- У 80% пациентов выявляются повышенные титры антител к вирусу Эбштейн-Бара.
- В лимфоцитах больных ревматоидным артритом Эбштейн-Бара выявляется намного чаще, чем у здоровых людей.
Выше были указаны факторы, которые создают предпосылки для развития заболевания. Выделяют также пусковые факторы, которые провоцируют его проявление у конкретного пациента в определенное время.
- Переохлаждение.
- Повышенное воздействие солнечного света (гиперинсоляция).
- Интоксикация, в том числе и токсинами микроорганизмов.
- Бактериальная инфекция.
- Прием некоторых лекарственных препаратов.
- Нарушение функции эндокринных желез.
- Эмоциональное перенапряжение и стрессы.
Что интересно, кормление грудью на протяжении двух лет и более снижает вероятность развития ревматоидного артрита в два раза.
Механизм развития ревматоидного артрита
Установлено, что при воздействии одного или комбинации провоцирующих факторов в организме пациента запускает неверная иммунная реакция. Собственные клетки вырабатывают вещества, которые вызывают повреждение синовиальной оболочки суставов. Сначала развивается синовиит, который впоследствии переходит в пролиферативную стадию и вызывает повреждение самого хряща и костей.
Также иммунитет вырабатывает патологические цитокины, которые обладают рядом отрицательных свойств:
- провоцируют выработку в повышенном количестве провоспалительных факторов, способствующих дальнейшему прогрессированию заболевания;
- активирую некоторые ферменты, которые способны разрушать хрящ, покрывающий сустав и обеспечивающий эластичное скольжение поверхностей;
- поставляют на мембраны тучных слеток специальные молекулы, которые заставляют эти лейкоциты проявлять аутоиммунное действие;
- привлекают в став дополнительные иммунокомпетентные клетки, которые также отрицательно сказываются на течении заболевания в данном случае;
- усиление ангиогенеза, что позволяет сосудам прорастать в хрящ и облегчает для агрессивных факторов попадание вглубь хрящевой ткани.
Классификация ревматоидного артрита
Есть несколько критериев, по которым классифицируется данное заболевание.
Клинико-анатомические формы
- Ревматоидный артрит (олигоартрит, моноартрит, полиартрит) – форма заболевания, при котором происходит поражение исключительно суставов, а другие органы нормально функционируют без нарушения функции.
- Ревматоидный артрит с системными проявлениями – дополнительно аутоиммунные процессы затрагивают серозные оболочки организма (перикард сердца, плевру), легкие, кровеносные сосуды, почки, нервную систему, вызывает отложение во внутренних органах патологического белка – амилоида.
- Ревматоидный артрит, сочетающийся с деформирующим остеоартрозом, ревматизмом.
- Ювенильный ревматоидный артрит.
Характеристика с точки зрения иммунологии
В зависимости от того, выявляется ли ревматоидный фактор в крови пациента, все случаи заболевания делят на серопозитивные и серонегативные. Это имеет большое значение для врачей во время диагностики и планирования предстоящего лечения.
Течение заболевани
- Медленно прогрессирующее – заболевание на протяжении многих лет медленно переходит на другие суставы, больные сочленения не сильно повреждаются.
- Быстро прогрессирующее – болезнь очень часто обостряется, постепенно вовлекая все больше суставов. Суставные поверхности претерпевают значительные изменения в худшую сторону. Лечение не дает большого эффекта.
- Без заметного прогрессирования – наиболее благоприятная форма. С которой пациент может прожить всю жизнь, сохранив достаточно высокое качество жизни.
Рентгенологическая стадия заболевания
- Околосуставной остеопороз – уменьшение плотности костной ткани за счет снижения содержания в ней кальциевых солей.
- Остеопороз, дополняющийся незначительным снижением суставной щели.
- Сужение суставной щели и остеопороз дополняются множественными узурами.
- Ко всему указанному выше присоединяются костные анкилозы – главная и самая стойкая причина снижения подвижности вплоть до полного ее отсутствия.
Узуры – это глубокие эрозии на суставной поверхности хрящей.
Степень функциональной недостаточности опорно-двигательного аппарата
- 0 – пациент может совершать все движения в полном объеме.
- 1 – человек не может в полной мере выполнять все движения, которые обеспечивают ему возможность выполнять свои профессиональные обязанности.
- 2 – пациент не может трудиться за счет утраты профессиональной трудоспособности.
- 3 – человек не может самостоятельно себя обслуживать в полной мере.
Симптомы ревматоидного артрита
На начальных этапах заболевание протекает без яркой клинической картины. Пациент может годами и не подозревать о том, что у него ревматоидный артрит. Ведущим клиническим проявлением болезни является суставной синдром.
- Утренняя скованность – специфическое проявление заболевания, на котором пациент не заостряет внимания. Во время сна синовиальные оболочки суставов несколько воспаляются за счет снижения секреции глюкокортикоидов в ночное время. Иногда пациенты просто не могут, нормально снять с себя одеяло. Спустя примерно час все симптомы проходят, и человек может активно двигаться.
- Периодические боли в суставах, снижение аппетита, усталость, похудание – все это можно отметить в продромальном периоде.
- Острые боли в суставах, лихорадка – вот так у пациента начинается болезнь. Чаще всего поражаются суставы кистей и стоп, запястья, коленные и локтевые. Другие сочленения поражаются реже. Около сустава отмечается отек, а поверхность кожных покровов имеет более высокую температуру, чем на остальном теле. Также область сустава гиперемирована за счет протекания воспалительных процессов.
- При пальпации суставы болезненны, движение в них ограничено. По мере прогрессирования болезни пролиферативные процессы начинают преобладать, и может происходить значительное ограничение подвижности, деформация и подвывих суставов.
- Ревматоидные узелки – специфическое проявление заболевания, при котором на разгибательной поверхности сустава можно пальпировать плотные подкожные образования. Этот признак является одним из важных диагностических критериев ревматоидного артрита.
Также у пациента могут поражаться практически все органы в теле, в зависимости от степени активности процесса, но это отмечается относительно редко.
Диагностика ревматоидного артрита
Лабораторные исследования
- Общий анализ крови – выявляют анемию, увеличение скорости оседания эритроцитов, увеличение количества лейкоцитов.
- Биохимическое исследование крови – позволяет определить степень активности воспалительного процесса.
- Иммунологическое исследование крови – может определяться ревматоидный фактор, иногда обнаруживаются иммунные комплексы.
Инструментальная диагностика
- Рентгенологическое исследование суставов – в классификации описаны все критерии, которыми руководствуются врачи при выставлении рентгенологической стадии заболевания.
- Радиоизотопное исследование – вводимый элемент активно накапливается в пораженных суставах, а нормальная синовиальная ткань привлекает не так много атомов.
- Пункция сустава и исследование синовиальной жидкости.
- В самых тяжелых случаях – биопсия участка синовиальной оболочки.
Ревматоидный артрит: лечение
Системное лечение данного заболевания предусматривает использование следующих основных групп препаратов:
- нестероидные противовоспалительные вещества;
- базисные препараты;
- гормональные вещества (глюкокортикоиды);
- биологические агенты.
Нестероидные противовоспалительные вещества
Эти лекарства уже относительно давно хорошо себя зарекомендовали в лечении ревматоидного артрита и до сих пор являются лечебными средствами первой линии. Они позволяют относительно быстро купировать острые проявления заболевания и иногда добиться наступления стойкой ремиссии – состояния, при котором симптомы болезни отсутствуют, и пациент может жить полноценной жизнью.
Если пациент попадает к ревматологу в острый период заболевания, то одними только нестероидными противовоспалительными препаратами не обходятся – дополняют их высокими дозами глюкокортикоидов. Этот способ лечения называется пульс-терапией.
Эффект достигается за счет блокирования циклооксигеназы – фермента, благодаря которому в норме арахидоновая кислота распадается с образованием простагландинов и прочих биологически активных веществ, играющих важное значение в развитии воспалительной реакции.
Более старые препараты инактивируют циклооксигеназу-1, за счет чего при передозировке может происходить нарушение функции почек, печени, развиваться энцефалопатия. Современные препараты, используемые для лечения ревматоидного артрита, имеют большую селективность и не так опасны, поэтому пациентам нечего опасаться.
Врачи избегают комбинирования нестероидных противовоспалительных препаратов друг с другом, поскольку в таком случае значительно повышается вероятность развития у пациента побочных реакций, а вот лечебный эффект остается практически неизменным.
Базисные препараты для лечения ревматоидного артрита
Наиболее популярными и эффективными лекарствами для лечения ревматоидного артрита в настоящее время являются: препараты золота, метотрексат, лефлуномид, пеницилламин, сульфасалазин.
Есть также средства резерва: циклофосфан, азатиоприн, циклоспорин – они используются тогда, когда основные препараты не дали желаемого эффекта.
Еще относительно недавно врачи предпочитали постепенно наращивать дозу препарата, получаемую пациентом (принцип пирамиды). В настоящее время доказано, что при начале лечения с использованием высоких доз можно добиться более впечатляющих результатов за счет изменения характера течения заболевания. Только что обнаруженный ревматоидный артрит характеризуется практически полным отсутствием изменений в суставах пациента и высокой вероятностью наступления длительной ремиссии.
Если на протяжении первых месяцев заболевания лечение базисными препаратами не приносит желаемого эффекта, то врачи комбинируют их с глюкокортикоидами. Гормональные препараты снижают активность воспалительного процесса и позволяют подобрать эффективную базисную терапию. Считается, что врачи должны подобрать эффективное лечение ревматоидного артрита препаратами данной группы за полгода.
В процессе лечения пациент должен периодически проходить медицинский осмотр на предмет наличия побочных эффектов от приема препаратов и оценки степени активность самого заболевания.
Глюкокортикоиды
Данная группа препаратов может использоваться по-разному.
- В виде пульс-терапии – прием пациентом высоких доз препарата в сочетании с веществами базисной терапии заболевания. Это позволяет очень быстро снизить активность процесса и убрать воспалительные явления. При этом курс приема препарата не может быть длительным ввиду высокой вероятности развития побочных эффектов.
- В виде курсового лечения с целью угнетения воспалительной реакции при неэффективности других веществ. В данном случае доза значительно отличается в меньшую сторону, а медики стараются подобрать ее таким образом, чтобы пациент принимал минимум гормона, который при этом окажет необходимое действие.
- Локальная терапия – в составе мазей, которыми смазывают пораженные суставы. Показанием в большинстве случаев является олигоартрит или моноартрит крупных суставов. Также использоваться они могут при наличии противопоказаний к системному лечению гормонами и значительным преобладанием местных симптомов над общими.
- Внутрисуставное введение геля, содержащего в своем составе гормональные препараты. Это позволяет на относительно длительное (до месяца) время обеспечить непрерывное воздействие препарата на поврежденную суставную поверхность.
Биологические средства
Моноклональные антитела к некоторым цитокинам обеспечивают нейтрализацию фактора некроза опухолей, который в случае ревматоидного артрита провоцирует поражение собственных тканей.
Также есть исследования, предлагающие использовать в качестве лечения ревматоидного артрита регуляторы дифференцировки лимфоцитов. Это позволит избежать повреждения синовиальных оболочек Т-лимфоцитами, которые неверно «направляются» в суставы иммунитетом.
Другие лечебные мероприятия
- Физиотерапевтические процедуры.
- Профилактика остеопороза.
- Лечебная гимнастика в период ремиссии.
- Хирургическая коррекция патологии суставов.
Источник
