Перифокальный отек при демиелинизации
или ПСЕВДОТУМОРОЗНАЯ ФОРМА РАССЕЯННОГО СКЛЕРОЗА
Введение. Существует такой МРТ-варианта рассеянного склероза (РС), как острая воспалительная демиелинизация (ОВД). Дебют заболевания при ОВД характеризуется многоочаговым поражением ЦНС с образованием крупного (>2 см), чаще всего сливного очага гиперинтенсивного на Т2-взвешенном изображении (ВИ) и умеренно гипоинтенсивного на Т1-ВИ. Подобный очаг часто сопровождается перифокальным отеком с масс-эффектом, иногда смещением срединных структур. Предполагается, что образование крупных очагов связано с бурным процессом воспаления. Выделяют две формы ОВД — псведотуморозную и острую диссиминированную энцефаломиелит-подобную. В большинстве случаев первая форма характеризуется бурной клинической картиной со столь же драматичным регрессом неврологических симптомов и обратным развитием сливного очага на МРТ. Для второго же варианта патогномоничным является образование крупных очагов, большинство из которых накапливают контраст, что свидетельствует о монофазности процесса. Именно эти формы РС создают трудности при диагностике и по своим клиническим и нейровизуализационным проявлениям имитируют опухоли нервной системы. В конце концов, нельзя забывать, что существует возможность параллельного развития двух патологических процессов — РС и опухоли ЦНС (например, В-клеточной лимфомы Ходжкина), что создает, в свою очередь, трудности при дифференциальной диагностике.
читайте также статью: Острый рассеянный энцефаломиелит (на laesus-de-liro.livejournal.com) [читать]
Псевдоопухолевый (псевдотуморозный) вариант РС (ПРС) развивается довольно редко: согласно крупному исследованию C.F. Lucchinetti et al. (2008) [168 случаев ПРС], распространенность его составляет 1 — 2 на 1000 случаев РС. Некоторые исследователи полагают, что опухолевидное течение РС чаще встречается у женщин, но другие исследования не выявили зависимости от пола. Средний возраст начала ПРС приходится на вторую и третью декады жизни и составляет в среднем 37 лет, хотя заболевание может встречаться в любом возрасте. В литературе описаны случаи дебюта ПРС в возрасте 2, а также в 87 лет. При этом необходимо иметь в виду, что диагностика ПРС у пожилых пациентов (старше 50 лет) еще более затруднительна в виду онкологической «настороженности», связанной с возрастом больных и довольно редким развитием РС у этого возрастного контингента.
Течение ПРС чаще острое или подострое, но могут наблюдаться и хронические формы. Развитие ПРС может быть первым признаком РС или же одним из вариантов проявления очередного обострения уже существующего заболевания. В некоторых случаях ПРС имеет монофазное течение и после регресса более не беспокоит больного. Иногда атаки ПРС повторяются несколько раз в различных участках ЦНС.
Клиническая картина заболевания полностью зависит от локализации и размеров опухолевидного очага. В большинстве своем очаг располагается супратенториально в полушариях головного мозга, причем чаще в лобной и теменной долях. Может наблюдаться локализация крупного очага демиелинизации в мосту, ножках мозжечка и в самом мозжечке. Патологический процесс нередко захватывает серое вещество — кору и подкорковые ядра. В том случае, когда очаг ПРС распространяется на мозолистое тело, может возникнуть так называемый симптом «бабочки» — признак более характерный для инфильтративной астроцитомы или лимфомы, нежели для демиелинизации. В литературе описан случай повторного псевдоопухолевого кистообразования в полушариях мозга, в морфологической основе которого лежала демиелинизация. Зарегистрированы случаи развития очагов ПРС в шейном и грудном отделах спинного мозга с вовлечением нескольких соседних сегментов.
В зависимости от локализации псевдотуморозного очага неврологическая симптоматика может включать в себя двигательные, чувствительные и мозжечковые нарушения, подобно классическому течению РС. Однако при ПРС клиницисты могут столкнуться с не очень типичными для этого заболевания симптомами, такими как нарушение высших корковых функций (афазия, апраксия, агнозия, аграфия, акалькулия), расстройства сознания, внимания, ориентации, памяти, эпилептические припадки и лихорадка. При классическом РС довольно часто обнаруживаются очаги в области зрительной лучистости, однако выпадение полей зрения — нетипичный признак для данной патологии. Исследование же Lucchinetti C.F. et al. (2008) показало, что гомонимная гемианопсия при ПРС наблюдается в 10% случаев. Заболевание может дебютировать в виде гипертензионного синдрома с характерными головными болями и рвотой. Имеется описание гидроцефального синдрома в связи с развитием компримирующего псевдотуморозного очага вблизи IV желудочка. Симптоматика может быть монофокальной или мультифокальной и развивается имитируя опухоль нервной системы, что и приводит, в первую очередь, к ошибочной диагностике.
При диагностике ПРС особо важное значение приобретает детальный сбор анамнеза заболевания — это касается выявления возможных атак РС в прошлом, что увеличит вероятность диагноза ПРС, нежели опухоли. Если все же в анамнезе пациента мы не можем проследить ранее перенесенные эпизоды неврологического неблагополучия, которые могли бы навести на мысль о демиелинизирующем заболевании и симптоматика носит одноочаговый характер, то в этом случае клиническая картина не может служить подспорьем для подозрения диагноза ПРС и возникает необходимость в дополнительных методах исследования.
Основным методом диагностики, который верифицирует очаг ПРС, является нейровизуализация. В отличие от очагов при типичномварианте РС, опухолевидный очаг в силу своего большого размера может быть выявлен при проведении компьютерной томографии. Выглядит он в виде крупного гиподенсивного очага, нередко накапливающего контрастное вещество, что еще в большей степени вводит в заблуждение относительно опухолевого процесса. И все-таки наиболее точный метод диагностики — магнитно-резонансная томография (МРТ). Псевдотуморозный очаг на МРТ выглядит как гиперинтенсивный участок на Т2-ВИ и относительно гипоинтенсивный на Т1-ВИ. Отличительной чертой этого очага является его размер — как известно, для классического РС характерно образование очагов преимущественно от 3 до 16 мм в диаметре (максимум 30 мм). Когда же мы имеем дело с псевдотуморозным течением РС, очаг превышаетв своих размерах 20 мм (до 120 мм). МРТ с контрастированием, как правило, не выявляет каких-либо специфических признаков ПРС (в некоторых случаях специфической чертой ПРС является особенность накопления контрастного вещества в виде арки, полкольца, пунктира или полумесяца, где открытая часть кольца соответствует границе с серым веществом или участку хронического воспаления, а часть очага, которая накапливает контраст, представляет собой участок активной демиелинизации, граничащий с неповрежденным белым веществом). Немаловажное значение имеет выполнение серий МРТ в течение болезни — иногда наблюдается быстрый самопроизвольный регресс очага (очагов) или уменьшение их размеров на фоне стероидной терапии, что, конечно же, больше свидетельствует в пользу ПРС. В отличие от опухолей, очаг (очаги) демиелинизации постепенно теряют способность накапливать контрастное вещество. В редких случаях они сохраняют эту способность дольше 4 — 6 недель. Напротив, в опухолях в силу повышенной васкуляризации часто обнаруживается накопление контраста в течение продолжительного времени, которое также сопровождается увеличением размера очага.
Обратите внимание! Нейровизуализация при ПРС не выявляет каких-либо специфических признаков, характерных только для него и служит, в первую очередь, поводом для подозрения опухолевого процесса и основанием для проведения биопсии. Единственным моментом, который может свидетельствовать в пользу ПРС и позволяет уменьшить вероятность выполнения биопсии, является обнаружение дополнительных очагов демиелинизации в головном или спинном мозге, которые располагаются в типичных для РС областях. Поэтому для исключения ПРС рекомендуется выполнение МРТ других отделов ЦНС. Однако опухолевидный очаг демиелинизации в некоторых случаях носит солитарный характер и дополнительные очаги при этом могут не обнаруживаться. В этих случаях немаловажное значение имеет выполнение серий МРТ в течение болезни (на фоне стероидной терапии). Исследование спинномозговой жидкости при ПРС на предмет наличия олигоклональных полосок имеет относительное значение — обнаружение последних может подтвердить ПРС, однако их отсутствие не опровергает данного диагноза. Исследование вызванных потенциалов (ВП) в некоторых случаях может обнаружить дополнительные очаги (например, на зрительных ВП), и это может послужить поводом для подозрения ПРС. В большинстве случаев образование достаточно крупного патологического очага в ЦНС требует выполнения диагностической биопсии и гистологического анализа полученных образцов (основными признаками, характерными для острого очагового демиелинизирующего процесса являются: деструкция миелиновых волокон белого вещества с уборкой продуктов их распада липофагами; пролиферация и гипертрофия астроцитов, продуцирующих глиальные волокна; воспалительные периваскулярные инфильтраты, состоящие из лимфоцитов, моноцитов и немногочисленных плазматических клеток; гиперемия мелких сосудов и капилляров; отек ткани мозга). По мнению ряда авторов выполнение диагностической стереотаксической биопсии мозга может быть рекомендовано только при отсутствии эффекта от пульс-терапии гормонами.
читайте также статью: «Обострение рассеянного склероза (принципы лечения)» на laesus-de-liro.livejournal.com [читать]
Как правило, состояние больных с ПРС значительно улучшается после пульс-терапии гормонами: наблюдаются регресс клинических проявлений и уменьшение размера или исчезновение очагов демиелинизации. Методом терапии второй линии является применение плаз-мафереза и цитостатиков. Имеются противоречивые данные касательно последующего развития заболевания. Некоторые авторы считают, что в большинстве случаев ПРС имеет монофазное течение и ограничивается только одной атакой. Если заболевание носит мультифазное течение, то в последующем может сформироваться типичная картина РС или больной переносит еще одну атаку ПРС. Пациенты, у которых развивается достоверный РС, имеют достаточно плохой прогноз — патологический процесс носит более агрессивное течение и устойчив к иммуномодулирующей терапии. До сих пор точно не выявлены факторы риска трансформации ПРС в РС. Считается, что риск последующего развития РС повышается, когда наряду с псевдотуморозным обнаруживаются дополнительные очаги демиелинизации в головном, спинном мозге на МРТ или при выполнении вызванных потенциалов, а также выявляются олигоклональные полосы в СМЖ.
читайте также статью: «Рассеянный склероз (лечение)» на laesus-de-liro.livejournal.com [читать]
использованы материалы 1. статьи «Псевдоопухолевый рассеянный склероз: клинические, нейровизуализа-ционные и морфологические аспекты диагностики» И.Ф. Хафизова, В.А. Абдульянов, А.Р. Хакимова, Э.З. Якупов; Казанский государственный медицинский университет, кафедра неврологии, нейрохирургии и медицинской генетики, кафедра патологической анатомии (2014); 2. статьи «Псевдотуморозный вариант течения рассеянного склероза и острой очаговой демиелинизации» О.Е. Гурьянова, Т.С. Гулевская, В.А. Моргунов, И.А. Завалишин; Научный центр неврологии РАМН, Москва (2012); 3. статьи «Диагностика и лечение рассеянного склероза» И.А. Завалишин, А.В. Переседова, Н.И. Стойда, О.Е. Гурьянова, Н.Ш. Арзуманян, Н.С. Алексеева, Д.Д. Елисеева, Т.С. Гулевская, В.В. Брюхов (2011) и др.
Источник
Соавтор: Сотников В. В., к.в.н., главный врач Ветеринарной клиники неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург.
Для выбора оптимальной лечебной тактики и планирования нейрохирургического вмешательства при опухолях головного мозга важно получить наиболее полную диагностическую информацию не только о локализации и гистологических свойствах опухоли, но и о выраженности и характере перифокальных реакций мозга, существенно влияющих на клинические проявления заболевания. Значительный перифокальный отек снижает выживаемость пациентов при менингиомах (Motta L, Mandara MT, Skerritt GC.2012).
Наиболее общей, закономерно развивающейся реакцией при очаговых поражениях (прежде всего при опухолях мозга) является перифокальный отек, в основе развития которого лежит взаимодействие сосудистого и паренхиматозного фактора.
Принято различать вазогенный и цитотоксический отеки мозга, которые могут сочетаться и изменять количественные соотношения в динамике развития в зависимости от вызвавшей их причины. Перифокальный отек при опухолях мозга формируется за счет увеличения объема внеклеточного пространства в результате накопления в нем жидкости, поступающей из поврежденных глиальных клеток, и вследствие повышения проницаемости клеточной мембраны эндотелия капилляров в зоне, окружающей очаг поражения. Распространенность зоны перифокального отека определяется не только увеличением содержания в ней воды, но и степенью регионарной демиелинизации волокон белого вещества мозга.
Чем выше степень демиелинизации, тем меньше содержание липидов в перифокальной зоне и тем более выражены нарушения процессов окисления и фосфорилирования, а также явления отека мозга (Chan Р.Н., Fishmann R.A. 1978). В прогрессировании перифокального отека основную роль играют два механизма: поступление в белое вещество мозга белков плазмы и их связывание с глиальными элементами; увеличение дальнейшего поступления жидкости в перивазальное пространство вследствие осмотического градиента; а также, по аналогичному механизму, поступление жидкости из ликворной системы (Priden F.R., Tsayumu M., Reulen H.J. 1979; S.Reulen H.J., Graber S., Huber P., Jto U. 1988).
Многочисленные исследования в гуманной медицине, проведенные в Институте нейрохирургии АМН Украины, свидетельствуют о существовании динамических различий между явлениями отека и набухания мозга. Отек — это увеличение содержания свободной воды в межклеточных интерстициальных пространствах, а набухание — это накопление свободной воды в клетках и связанной воды в межклеточных пространствах. Для внутримозговых опухолей, особенно для глиом, характерно преобладание отека в перифокальной зоне (О.Ю.Чувашова 2000).
По мере увеличения объема опухоли и нарастания явлений внутричерепной гипертензии изменяется белковый состав как в очаге поражения, так и в перифокальной зоне, в которой эти сдвиги коррелируют со степенью злокачественности опухоли. При этом развиваются регионарные нарушения проницаемости гематоэнцефалического барьера, которые увеличивают цитотоксический отек. Определенную роль в этом процессе, по-видимому, играет обнаруженный недавно в головном мозге специфический белок — фактор проницаемости сосудов, стимулирующий ангиогенез в опухолевой ткани и повышающий проницаемость капилляров, причем обнаружена корреляция между концентрацией этого белка и выраженностью перифокального отека.
Изложенные предпосылки обосновывают поиски возможностей неинвазивного получения диагностической информации, характеризующей выраженность перифокального отека мозга при глиомах с учетом их локализации, величины и гистологических свойств.
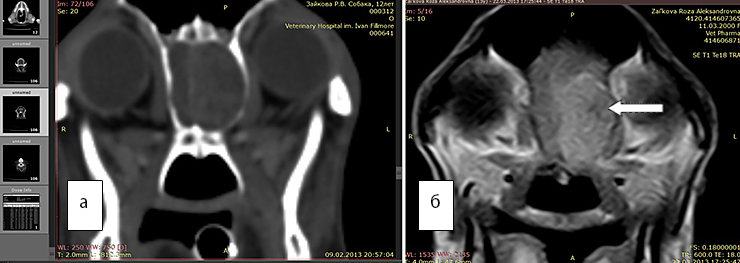
По данным МРТ границы глиом и перифокального отека оптимально отличаются в Т2 режиме, поскольку интенсивность сигнала возрастает в зоне большого накопления экстрацеллюлярной жидкости. Рис 1(а)
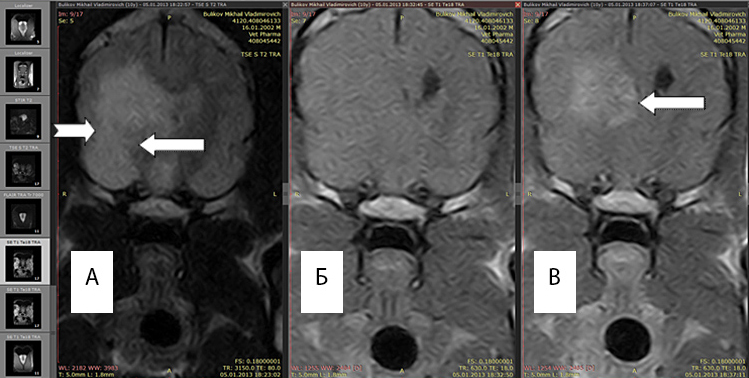 Рис. 1А. Т2 режим, хорошо выражен перифокальный отек (белые стрелки).
Рис. 1А. Т2 режим, хорошо выражен перифокальный отек (белые стрелки).
Рис. 1Б. Т1 режим без введения контраста, отсутствует правый желудочек, имеется смещение срединных структур.
Рис. 1В. Т1 режим с введенным контрастным препаратом «Магневист». Регистрируется интенсивный сигнал от новообразования (обозначено стрелкой), перифокальный отек не виден.
Возможность выявления границ между опухолью и зоной перифокального отека повышается при повторном МРТ-исследовании после введения магнитоусиливающих препаратов (магневист). Поскольку магневист не проникает через неповрежденный гематоэнцефалический барьер, сопоставление томограмм, полученных до и после введения препарата, позволяет судить о регионарных нарушениях проницаемости барьера. Рис 1(A,B)
Это особенно отчетливо проявляется при астроцитомах типичной структуры, при которых функция гематопаренхиматозного барьера на границе опухоли и прилегающих участках мозга до определенного времени остается относительно сохранной, поэтому магневист не проникает в ткань опухоли.
В связи с этим зона гипоинтенсивности сигнала более отчетливо определяется в проекции астроцитомы, чем в области перифокального отека. Оценка размеров и распространения глиом более точна на МРТ, чем на КТ (Кобяков Г.Л., Коновалов А.Н., Личиницер М.Р. 2001; Коновалов A.Н., Корниенко В.Н. 1985; Коновалов А.Н., Корниенко В.Н., Пронин И.Н., 1997.; Yamada K., Soreusen A.G. 2000).
Существует большая точность и разрешающая способность МРТ в диагностике глиом полушарий мозга, этот метод не сопоставим с данными, полученными при КТ-исследовании. Он позволяет более точно определить вид опухоли, степень ее анаплазии и выраженность перифокального отека мозга, что имеет важное значение для выбора наиболее рациональной противоотечной терапии в процессе предоперационной подготовки и планирования хирургического вмешательства (рис. 2,3,4,5,6). На всех рисунках представлены справа результаты МРТ — изображения, а слева — КТ в аналогичных срезах.
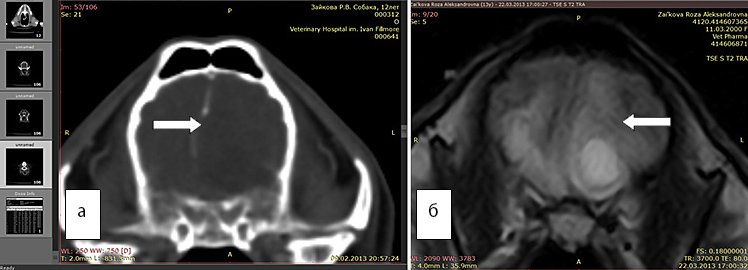 Рис. 2 а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 2 а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 2б. МРТ. Хорошо виден перифокальный отек
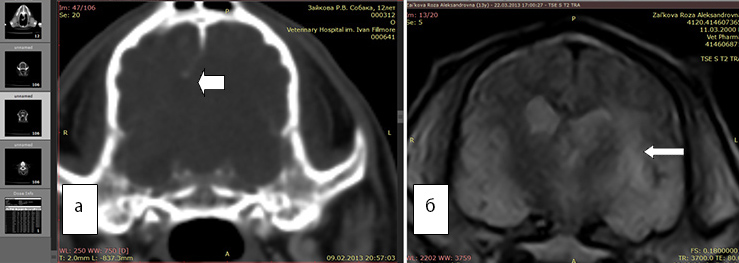 Рис. 3а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 3а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 3б. МРТ. Хорошо виден перифокальный отек
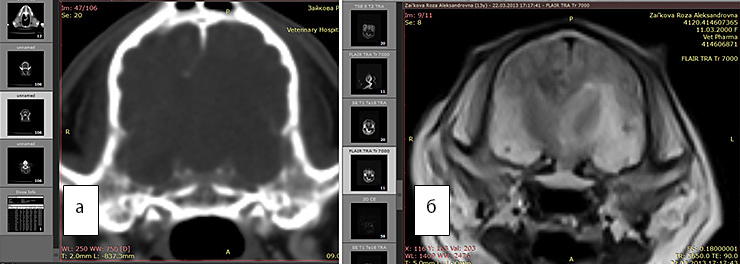 Рис. 4а. КТ. Заметно смещение срединных структур.Отек не виден
Рис. 4а. КТ. Заметно смещение срединных структур.Отек не виден
Рис. 4б. МРТ. Хорошо виден перифокальный отек. FLAIR последовательность
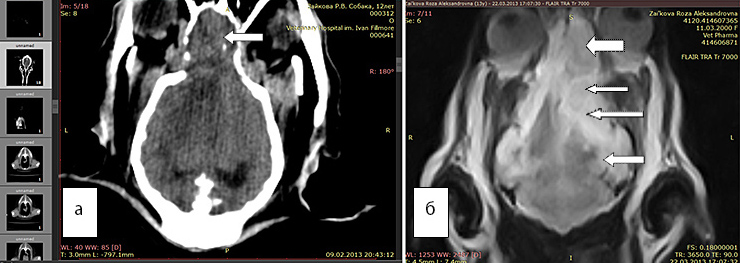 Рис. 5а. КТ. Перифокальный отек плохо виден, но новообразование хорошо заметно (стрелка)
Рис. 5а. КТ. Перифокальный отек плохо виден, но новообразование хорошо заметно (стрелка)
Рис. 5б. МРТ. Видно новообразование (большая стрелка), отек наиболее хорошо виден в программе FLAIR (маленькие стрелки)
 Рис 6а. КТ. В области обонятельной луковицы визуализируется новообразование
Рис 6а. КТ. В области обонятельной луковицы визуализируется новообразование
Рис. 6б. МРТ. Т1 режим с контрастом дает возможность гораздо точнее оценить объем новообразования, его границы
Представленные выше рисунки демонстрируют, что визуализация новообразования головного мозга, перифокального отека и его распространенности гораздо информативнее при использовании МРТ, чем КТ. Улучшить визуализацию помогает использование контраста, а также последовательного выполнения программ: для оценки перифокального отека целесообразно использовать FLAIR импульсную последовательность МРТ. Т2-взвешенные изображения, широко использующиеся для выявления патологических изменений, не всегда позволяют с достаточной надежностью различать зоны поражения и некоторые нормальные ткани. Так, на Т2-взвешенных изображениях зоны патологических изменений вещества мозга часто имеют высокий сигнал и выглядят как более яркие участки. Аналогичный высокий сигнал имеет также нормальная спинномозговая жидкость, что затрудняет выявление патологических очагов, располагающихся около пространств, заполненных данной жидкостью. Для преодоления данного недостатка разработана методика FLAIR (Fluid Attenuated Inversion Recovery), обеспечивающая подавление сигнала свободной воды (спинномозговой и некоторых других физиологических жидкостей) при сохранении базовой Т2-взвешенности изображения. FLAIR лучше выявляет очаговые изменения мозга.
Нельзя не отметить, что (по нашим данным наблюдения 35 пациентов) оценить наличие и размер перифокального отека при ЭЭГ — исследовании невозможно. Такая же ситуация существует и в гуманной медицине. Изменения биоэлектрической активности мозга (ЭЭГ) при глиальных опухолях неспецифичны и отражают реакцию мозга на поражение, развивающееся в нем. В дооперационном периоде ЭЭГ позволяет получить объективную информацию о функциональном состоянии мозга, выявить наличие и локализацию эпилептического очага у пациентов, имеющих эпилептические припадки (Фадеева Т.Н. 2004). Следует исходить из данных о том, что опухолевая ткань электрически нейтральна, поэтому на ЭЭГ нет отражения места локализации опухоли. Однако при проведении противоотечной терапии (дексаметазон 1мг/кг 2 раза в день) перед оперативным лечением либо при неоперабельных опухолях вместе с регрессом неврологических симптомов очень быстро происходит нормализация электрической активности головного мозга, что, несомненно, указывает на влияние перифокального отека на электрическую активность мозга.
Список литературы:
- Chan Р.Н., Fishmann R.A. Brain edema: induction in cortical slices by polyunsaturated fatty acids //Science. — 1978. — V.201, №5607. — P.358—360.
- Priden F.R., Tsayumu M., Reulen H.J. Measurement of vasogenic brain edema clearance into ventricular CSF //Surg. Forum. — 1979. — V.30, №5. — P. 446—453.
- S.Reulen H.J., Graber S., Huber P., Jto U. Factors off ecting the extension of peritumoral brain oedema ACT-study //Acta Neurochir. — 1988. — V.96, №1—2. — P. 19—24.
- Motta L., Mandara M. T., Skerritt G. C. Canine and feline intracranial meningiomas: an updated review. The Veterinary Journal, 192, 153-165. Source ChesterGates Animal Referral Hospital, Chester Gate Road, Telford Court, Unit E-F, Chester CH16LT, United Kingdom.
- Чувашова О.Ю. Характеристика перифокального отека при глиомах полушарий головного мозга различной степени анаплазии по данным компьютерной и магнитно-резонансной томографии. Институт нейрохирургии им. акад. А.П.Ромоданова АМН Украины, г. Киев. 2000.
- Кобяков Г.Л., Коновалов А.Н., Личиницер М.Р. и др. Современные возможности химиотерапии в лечении злокачественных опухолей // Современные минимально-инвазивные технологии (нейрохирургия, вертебрология, неврология, нейрофизиология): Материалы симпозиума. — СПб., 2001.—С. 251-253.
- Коновалов A.Н., Корниенко В.Н. Компьютерная томография в нейрохирургической клинике. — М.: Медицина, 1985.— С. 20—44.
- Коновалов А.Н., Корниенко В.Н., Пронин И.Н. Магнитно-резонансная томография в нейрохирургии. — М.: Видар, 1997.—С. 95-134.
- Yamada K., Soreusen A.G. Diagnostic imaging // Neurooncology. The Essentials. — New York, 2000. — Ch. 6. — P. 56 —77
Источник
