Нейрогенный отек легких патогенез
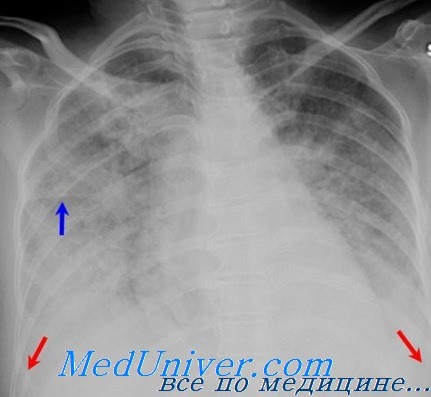
Дыхательная недостаточность является одним из наиболее часто развивающихся внечерепных осложнений острой церебральной патологии — различных острых заболеваний и травм головного мозга (ГМ). Она возникает в среднем у 80% пациентов с тяжелым повреждением центральной нервной системы (ЦНС). Ее развитие может существенным образом утяжелять состояние пациента, негативно сказываться на течении основного заболевания и в ряде случаев становиться самостоятельной клинической проблемой, требующей применения дополнительных средств и методов лечения.
Справочная информация. Дыхательная недостаточность — состояние организма, при котором либо не обеспечивается поддержание нормального газового состава артериальной крови, либо оно достигается за счет повышенной работы внешнего дыхания, приводящей к снижению функциональных возможностей организма, либо поддерживается искусственным путем. Для острой дыхательной недостаточности характерны: одышка и диспноэ (изменение частоты, ритма и глубины дыхания), участие в акте дыхания вспомогательной мускулатуры, тахикардия, артериальная гипертензия или гипотензия, цианоз, когнитивные нарушения, угнетение сознания, делирий.
Наиболее частыми причинами дыхательной недостаточности являются вентилятор-ассоциированная пневмония и острый респираторный дистресс-синдром (ОРДС). Но, наряду с ними, многие авторы выделяют также такое осложнение острого повреждения ГМ, как нейрогенный отек легких (НОЛ). Наличие специфической связи между повреждением ЦНС и развитием отека легких подтверждают данные, полученные при кондиционировании доноров органов (по данным D. McKeown et al., НОЛ у пациентов со смертью ГМ развивается в 13 — 18% случаев [2012]).
Чаще всего НОЛ диагностируют при нетравматических субарахноидальных кровоизлияниях (САК) и черепно-мозговой травме (ЧМТ). Развитие НОЛ описано также при таких заболеваниях ЦНС, как эпилепсия, опухоли ГМ, рассеянный склероз, но эти сведения носят единичный характер и не поддаются системному анализу.
В настоящий момент нет точных данных о частоте развития НОЛ при различных острых заболеваниях и травмах ГМ. Это связано с объективными трудностями дифференциальной диагностики НОЛ с другими видами отека легких. Например, при САК частота возникновения НОЛ, по данным различных авторов, варьирует от 2 до 23%. При этом она находится в прямой взаимосвязи с возрастом пациента, сроками хирургического вмешательства, локализацией аневризм в вертебрально-базилярном бассейне, а также со степенью тяжести состояния по шкале Hunt-Hess и с рентгенологическими признаками выраженности кровоизлияния по градации Fisher.
Патогенез НОЛ до конца не изучен. В настоящее время наиболее обсуждаемой теорией возникновения НОЛ является предложенная L. Mascia в 2009 году теория «двойного удара». Она заключается в последовательном воздействии на легкие двух групп повреждающих факторов. Первую волну агрессии вызывают провоспалительные цитокины, фактор некроза опухоли и другие медиаторы системной воспалительной реакции. Их источником являются микроглия и астроциты, которые в большом количестве выбрасывают эти медиаторы воспаления при остром повреждении ГМ. Кроме того, росту концентрации в крови этих веществ способствует возникающее в результате прямого поражения ЦНС повышение проницаемости гематоэнцефалического барьера. Вследствие воздействия на эндотелий легочных капилляров провоспалительных веществ происходит увеличение его проницаемости, что на фоне активации симпатоадреналовой* системы, вызывающей повышение давления в малом круге кровообращения, приводит к перемещению воды, электролитов, крупных белковых молекул и форменных элементов крови в интерстициальное пространство легких, а в последующем и в альвеолы (* в патогенезе развития НОЛ в настоящее время многие исследователи отводят ведущую роль активации симпатической нервной системы, возникающей при остром повреждении ГМ, с последующей гиперкатехоламинемией). По-сути — это ОРДС [взрослых]. Вторым же «ударом» авторы теории считают повреждение легких, возникающее в результате воздействия искусственной вентиляции (ИВЛ), проводимой на фоне уже имеющегося ОРДС. Применение высокого дыхательного объема способствует возникновению баро- и волюмотравмы, а использование неправильно подобранного положительного давления в конце выдоха (ПДКВ) вызывает ателектотравму легочной паренхимы. Более того, легкие пациентов с острыми заболеваниями и травмами ГМ после «первого удара» становятся более восприимчивы ко вторичным факторам агрессии. При этом механически повреждаемые при проведении ИВЛ они сами становятся источником факторов воспаления, которые вызывают их дополнительное повторное поражение.
Обратите внимание! В теории «двойного удара» модель повреждения легких при остром повреждении ГМ по своей сути практически ничем не отличается от ОРДС, который формируется при травматической болезни, сепсисе, панкреонекрозе и иных патологических состояниях, сопровождающихся системной воспалительной реакцией, с той лишь разницей, что источником медиаторов воспаления, индуцирующих дальнейший каскад патофизиологических изменений, является поврежденный ГМ. [!!!] Это позволяет в настоящий момент рассматривать НОЛ как особую форму ОРДС, диагностируемую на основании общепринятых критериев, дополненных наличием тяжелого повреждения ЦНС и отсутствием связи с иными этиологическими факторами.
Справочная информация. Клинические признаки ОРДС [взрослых] могут быть вначале невыраженными и оставаться незамеченными: могут развиваться в течение нескольких часов или дней, например, при сепсисе (т.е. имеет место «светлый промежуток» между воздействующим фактором и началом клинических проявлений — от 10 — 12 ч до 2 — 3 дней). Иногда развитие ОРДС совпадает с инцидентом, который может вызвать это осложнение (например, аспирация желудочного содержимого). Общие признаки — одышка, сухой кашель, дискомфорт за грудиной, состояние неполной адекватности. Более отчетливые признаки появляются при умеренно выраженной или тяжелой форме ОРДС. В этот период развивается цианоз. При аускультации легких — бронхиальное дыхание, возможны грубые крипитирующие хрипы. Состояние пациента ухудшается: у него нарастает тяжелая дыхательная недостаточность по гипоксемическому варианту. ОРДС достигает пика в среднем через 24 — 48 часов от начала повреждения и заканчивается массивным, обычно двусторонним поражением легочной ткани (на прямой рентгенограмме грудной клетки видны инфильтраты в обоих легких, т. е. двустороннее поражение).
[увеличить]читайте также статью «Острый внелегочный респираторный дистресс-синдром: определение, этиопатогенез, клинические и лабораторные проявления (обзор литературы с элементами критики)» В.Л. Кассиль (журнал «Клиническая онкогематология» №1, 2011) [читать]
Описано две клинические формы НОЛ. [1] Первая носит название фульминантной и характеризуется быстрым развитием в течение первых нескольких часов после острого повреждения ГМ. Возникновение этой формы связано с высокой летальностью пациентов. По разным оценкам, она составляет от 60 до 100%. [2] Вторая форма носит название отсроченной и возникает через 12 — 24 ч после тяжелого поражения ГМ. Летальность при этом варианте НОЛ составляет около 50%.
Эффективные методы оценки риска развития данного состояния, средства его профилактики или методы воздействия на отдельные звенья его патогенеза не разработаны. Ключевой задачей в лечении НОЛ является поддержание газообмена. Ведущая роль в этом отводится [!!!] ИВЛ, которую рекомендовано проводить с использованием принципов протективной вентиляции легких. При этом реализацию отдельных подходов к профилактике вентиляториндуцированного повреждения легких целесообразно проводить только в условиях мониторинга внутричерепного давления (ВЧД).
по материалам статьи «Нейрогенный отек легких» В.И. Шаталов, А.В. Щеголев, А.Н. Грицай, В.С. Афончиков; ФГБВОУ ВО «Военно-медицинская академия им. С. М. Кирова» МО РФ, Санкт-Петербург: ГБУ «Санкт-Петербургский научно-исследовательский институт скорой помощи им. И.И. Джанелидзе», Санкт-Петербург (журнал «Вестник анестезиологии и реаниматологии» №1, 2018) [читать]; Читайте также:
статья «Компьютерная томография в диагностике острого респираторного дистресс-синдрома у пациентов с тяжелой черепно-мозговой травмой» Агафонова Н.В., ФГЛПУ «Научно-клинический центр охраны здоровья шахтеров» г. Ленинск-Кузнецкий (журнал «Политравма» №1, 2006) [читать];
Источник
Нейрогенный отек легких(НЕОЛ) возникает вследствие увеличения количества жидкости в интерстициальной ткани, а также ее пропитывания на поверхность альвеол. Отек обычно развивается очень быстро после повреждения центральных структур головного мозга. Эти клинические проявления трактуются, как острый респираторный дистресс-синдром, хотя патофизиологические механизмы и прогноз значительно отличаются от некардиогенного отека легких.
НЕОЛ развивается у лиц с травмами головы, когда пораженные поступают в госпитали с травмой головы. В мирное время это проблема пострадавших в транспортных авариях. При аускультации легких выявляются влажные хрипы, которые выслушиваются как в верхних, так и в нижних отделах легких. При рентгенографии выявляются застойные признаки в легких, при этом размеры сердца не изменены. Гемодинамические параметры, такие как артериальное давление, давление заклинивания, сердечный выброс – в пределах физиологической нормы. Эти признаки являются важными в проведении дифференциальной диагностики между различными формами отека легких.
Нейрогенный отек легких является довольно редким видом некардиогенного отека легких. При данной патологии вследствие нарушения иннервации сосудов дыхательной системы происходит значительный спазм вен. В дальнейшем это приводит к повышению гидростатического давления крови внутри капилляров (мельчайшие сосуды, которые участвуют вместе с альвеолами в процессе газообмена). Как следствие жидкая часть крови выходит из кровяного русла в межклеточное пространство легких, а затем попадает и в сами альвеолы (происходит отек легких).
Нейрогенные отеки. При некоторых видах отеков роль нервной системы выступает наиболее ярко и непосредственно, так как нервная система обеспечивает трофику сосудистой стенки и обменных процессов в тканях. Такие отеки называют нейрогенными. В их происхождении важную роль играют повышение проницаемости сосудистых стенок и нарушение обмена веществ в тканях с развитием метаболического ацидоза. Так, например, развиваются отеки конечностей при сирингомиелии (образование полостей в сером веществе спинного мозга) и сухотке спинного мозга (поражение задних рогов и столбов спинного мозга). Невралгия тройничного нерва нередко сопровождается развитием отека лица. К нейрогенным относятся отеки кожи при истерии, контузионные отеки и др.
Перечислить основные принципы терапии и профилактики отека легких.
Срочная медицинская помощь при отеке легких
| Терапевтические мероприятия | Механизм действия |
| Прием наркотических обезболивающих медикаментов (морфин). Морфин следует вводить по 10 миллиграмм внутривенно дробно. | Данные медикаменты способствуют устранению одышки и снимают психоэмоциональный стресс (уменьшают выработку адреналина и норадреналина). Также морфин приводит к умеренному расширению вен, что приводит к уменьшению выраженности клинических симптомов отека легких. |
| Оксигенотерапия (ингаляция кислорода) с парами этилового спирта со скоростью 3 – 6 литров в минуту. | В значительной степени снижает гипоксию (кислородное голодание). Гипоксия крайне неблагоприятно воздействует на сосуды легких, увеличивая их проницаемость, а также увеличивая застой в малом круге кровообращения (сосуды, которые участвую в переносе крови от сердца к легким и наоборот). Оксигенотерапия является одним из самых важных мероприятий и назначается при любом виде отека легких (при кардиогенном и некардиогенном). |
| Прием нитратов (нитроглицерин) внутрь по 1 – 2 таблетки через 3 – 5 минут. Также возможно внутривенное введение до 25 мкг болюсно (быстрое введение всего содержимого шприца), а затем капельное введение с увеличением дозы. | Нитраты в определенной степени уменьшают застой венозной крови в легких, за счет расширения стенок вен. В больших дозах нитраты способны расширять и коронарные сосуды, питающие сердце. Также данные лекарственные средства уменьшают нагрузку на миокард (мышечный слой) левого желудочка. Необходимо заметить, что использование нитратов необходимо лишь в том случае, когда отек легких был вызван инфарктом миокарда (наиболее частая причина отека легких) и строго запрещено при гипертонической кардиомиопатии (утолщение мышечного слоя левого желудочка). |
| Прием мочегонных препаратов (фуросемид). Медикамент вводят внутривенно в разовой дозе 40 миллиграмм. В дальнейшем фуросемид можно ввести повторно. | Мочегонные медикаменты (диуретики) вызывают снижение объема циркулирующей крови. Вначале фуросемид несколько расширяет вены (вызывает венодилатацию), а затем, воздействуя на почечные канальца, оказывает мочегонное действие (усиливает выведение ионов натрия, кальция, магния и хлора). При внутривенном использовании терапевтическое действие наблюдается уже через 10 минут, а при приеме внутрь (таблетированная форма) – в течение 30 – 60 минут. |
| Прием препаратов, блокирующих АПФ (ангиотензинпревращающий фермент). Препараты данной группы (эналаприлат) вводятся внутривенно в разовой дозе от 1,25 до 5 миллиграмм. | Блокаторы АПФ в определенной степени снижают объем циркулирующей крови за счет уменьшения уровня особого фермента ангиотензина. Данный фермент не только суживает сосуды, но также и повышает выработку гормона альдостерона, который вызывает задержку жидкости в организме. Данные лекарственные средства способны расширять артериолы (артерии мелкого калибра) и тем самым уменьшать нагрузку на левый желудочек сердца. |
Помимо вышеперечисленных мероприятий, лечение должно быть также направлено на причину, которая вызвала отек легких.
Источник
Осложнения со стороны дыхательной системы при черепно-мозговой травме (ЧМТ). Нейрогенный отек легкихСмертность и инвалидизация после острой травмы мозга определяются не только тяжестью самой травмы, но и развитием осложнений. Возникновение системных осложнений неудивительно, учитывая что мозг контролирует большую часть систем организма с помощью гуморальных, биохимических, вегетативных и невральных механизмов обратной связи. Анатомическое или физиологическое повреждение этих центральных систем неизбежно ведет к дисфункции связанных с ними органов. Угнетение сознания является признаком повреждения мозга:
Дополнительные факторы риска развития пневмонии у пациентов с поврежлениями мозга: Нейрогенный отек легкихЭто отек легких с острым началом, обычно возникающий через 4-12 часов после повреждения мозга, но возможно и отсроченное проявление. — Также рекомендуем «Сердечно-сосудистые осложнения при черепно-мозговой травме (ЧМТ). Нарушения водно-электролитного обмена» Оглавление темы «Ведение пациентов с травмой мозга»:
|
Источник
1. Ainslie P. N., Duffin J. Integration of cerebrovascular CO2 reactivity and chemoreflex control of breathing: mechanisms of regulation, measurement, and interpretation // Am. J. Physiol. Regul. Integr. Comp. Physiol. – 2009. – Vol. 296, № 5. – P. R1473-R1495.
2. ARDSnet ventilation protocol summary; 2008. https://www.ardsnet. org/files/ventilator_protocol_2008-07.pdf
3. Bahloul M., Chaari A. N., Kallel H. et al. Neurogenic pulmonary edema due to traumatic brain injury: evidence of cardiac dysfunction // Am. J. Crit. Care. – 2006. – Vol. 15. – P. 462–470.
4. Bein T., Kuhr L. P., Bele S. et al. Lung recruitment maneuver in patients with cerebral injury: effects on intracranial pressure and cerebral metabolism // Intens. Care Med. – 2002. – Vol. 28, № 5. – P. 554–558.
5. Boone M. D., Jinadasa S. P., Mueller A. et al. The effect of positive end-expiratory pressure on intracranial pressure and cerebral hemodynamics // Neurocrit. Care. – 2017. – Vol. 26, № 2. – Р. 174–181.
6. Bowers R. E., McKeen C. R., Park B. E. et al. Increased pulmonary vascular permeability follows intracranial hypertension in sheep // Am. Rev. Respir. Dis. – 1979. – Vol. 119. – P. 637–641.
7. Busl K. M., Bleck T. P. Neurogenic Pulmonary Edema // Crit. Care Med. – 2015. – Vol. 43, № 8. – Р. 1710–1715.
8. Carlson R. W., Schaeffer R. C. Jr., Michaels S. G. et al. Pulmonary edema following intracranial hemorrhage // Chest. – 1979. – Vol. 16. – P. 731–734.
9. Connor R. C. Myocardial damage secondary to brain lesions // Am. Heart J. – 1969. – Vol. 78. – P. 145–148.
10. Davison D. L., Terek M., Chawla L. S. Neurogenic pulmonary edema // Crit. Care. – 2012. – Vol. 16, № 2. – Р. 212.
11. Davison D. L., Chawla L. S., Selassie L. et al. Neurogenic pulmonary edema: successful treatment with IV phentolamine // Chest. – 2012. – Vol. 141, № 3. – P. 793–795.
12. Ducker T. B., Simmons R. L. Increased intracranial pressure and pulmonary edema. 2. The hemodynamic response of dogs and monkeys to increased intracranial pressure // J. Neurosurg. – 1968. – Vol. 16. – P. 118–123.
13. Fein I. A., Rackow E. C. Neurogenic pulmonary edema // Chest. – 1982. – Vol. 16. – P. 318–320.
14. Friedman J. A., Pichelmann M. A., Piepgras D. G. et al. Pulmonary complications of aneurysmal subarachnoid hemorrhage // Neurosurgery. – 2003. – Vol. 52. – P. 1025–1031.
15. Gentiloni N., Schiavino D., Della Corte F. et al. Neurogenic pulmonary edema: a presenting symptom in multiple sclerosis // Ital. J. Neurol. Sci. – 1992. – Vol. 13. – P. 435–438.
16. Gyo Jun Hwang, Seung Hun Sheen, Hyoung Soo Kim et al. Extracorporeal membrane oxygenation for acute life-threatening neurogenic pulmonary edema following rupture of an intracranial aneurysm // J. Korean Med. Sci. – 2013. – Vol. 28, № 6. – P. 962–964.
17. Habgood M. D., Bye N., Dziegielewska K. M. et al. Changes in blood-brain barrier permeability to large and small molecules following traumatic brain injury in mice // Eur. J. Neurosci. – 2007. – Vol. 25. – P. 231–238.
18. Heuer J. F., Pelosi P., Hermann P. et al. Acute effects of intracranial hypertension and ARDS on pulmonary and neuronal damage: a randomized experimental study in pigs // Intens. Care Med. – 2011. – Vol. 37. – P. 1182–1191.
19. Holland M. C., Mackersie R. C., Morabito D. et al. The development of acute lung injury is associated with worse neurologic outcome in patients with severe traumatic brain injury // J. Trauma. – 2003. – Vol. 55. – P. 106–111.
20. Huseby J. S., Luce J. M., Cary J. M. et al. Effects of positive end-expiratory pressure on intracranial pressure in dogs with intracranial hypertension // J. Neurosurg. – 1981. – Vol. 55, № 5. – P. 704–705.
21. Imai K. Radiographical investigations of organic lesions of the hypothalamus in patients suff ering from neurogenic pulmonary edema due to serious intracranial diseases: relationship between radiographical findings and outcome of patients suff ering from neurogenic pulmonary edema // No Shinkei Geka. – 2003. – Vol. 31. – P. 757–765.
22. Inamasu J., Sugimoto K., Yamada Y. et al. The role of catecholamines in the pathogenesis of neurogenic pulmonary edema associated with subarachnoid hemorrhage // Acta Neurochir. (Wien). – 2012. – Vol. 154, № 12. – P. 2179–2184.
23. Lee K., Rincon F. Pulmonary complications in patients with severe brain injury // Crit. Care Res. Pract. – 2012. – 2012:207247.
24. Lima W. A., Campelo A. R., Gomes R. L. et al. The impact of positive end-expiratory pressure on cerebral perfusion pressure in adult patients with hemorrhagic stroke // Rev. Bras. Ter. Intensiva. – 2011. – Vol. 23, № 3. – Р. 291–296.
25. López-Aguilar J., Villagrá A., Bernabé F. et al. Massive brain injury enhances lung damage in an isolated lung model of ventilator-induced lung injury // Crit. Care Med. – 2005. – Vol. 33. – P. 1077–1083.
26. Maron M. B. Effect of elevated vascular pressure transients on protein permeability in the lung // J. Appl. Physiol. – 1989. – Vol. 67. – P. 305–310.
27. Mascia L. Acute lung injury in patients with severe brain injury: a double hit model // Neurocrit. Care. – 2009. – Vol. 11. – P. 417–426.
28. Mascia L., Zavala E., Bosma K. et al. High tidal volume is associated with the development of acute lung injury after severe brain injury: an international observational study // Crit. Care Med. – 2007. – Vol. 35. – P. 1815–1820.
29. Mayer S. A., Lin J., Homma S. et al. Myocardial injury and left ventricular performance after subarachnoid hemorrhage // Stroke. – 1999. – Vol. 30. – P. 780–786.
30. McClellan M. D., Dauber I. M., Weil J. V. Elevated intracranial pressure increases pulmonary vascular permeability to protein // J. Appl. Physiol. – 1989. – Vol. 67. – P. 1185–1191.
31. McKeown D. W., Bonser R. S., Kellum J. A. Management of the heartbeating brain-dead organ donor // Br. J. Anaesth. – 2012. – Vol. 108 (Suppl. 1). – P. 96–107.
32. Moutier F. Hypertension et mort par oedeme pulmo aigu chez les blesses cranio-encephaliques // Presse Méd. – 1918. – Vol. 16. – Р. 108–109.
33. Mrozek S., Constantin J. M., Geeraerts T. Brain-lung crosstalk: Implications for neurocritical care patients // World J. Crit. Care Med. – 2015. – Vol. 4, № 3. – P. 163–178.
34. Muroi C., Keller M., Pangalu A. et al. Neurogenic pulmonary edema in patients with subarachnoid hemorrhage // J. Neurosurg. Anesthesiol. – 2008. – Vol. 20 – P. 188–192.
35. Nathan M. A., Reis D. J. Fulminating arterial hypertension with pulmonary edema from release of adrenomedullary catecholamines after lesions of the anterior hypothalamus in the rat // Circ. Res. – 1975. – Vol. 16. – P. 226–235.
36. Nemer S. N., Caldeira J. B., Azeredo L. M. et al. Alveolar recruitment maneuver in patients with subarachnoid hemorrhage and acute respiratory distress syndrome: a comparison of 2 approaches // J. Crit. Care. – 2011. – Vol. 26, № 1. – P. 22–27.
37. Ochiai H., Yamakawa Y., Kubota E. Deformation of the ventrolateral medulla oblongata by subarachnoid hemorrhage from ruptured vertebral artery aneurysms causes neurogenic pulmonary edema // Neurol. Med. Chir. (Tokyo). – 2001. – Vol. 41, № 11. – P. 529–534.
38. Park E. S., Son H. W., Lee A. R. et al. Inhaled nitric oxide for the brain dead donor with neurogenic pulmonary edema during anesthesia for organ donation: A case report // Korean J. Anesthesiol. – 2014. – Vol. 67. – P. 133–138.
39. Peter J. V., John P., Graham P. L. et al. Corticosteroids in the prevention andtreatment of acute respiratory distress syndrome (ARDS) in adults: metaanalysis // BMJ. – 2008. – Vol. 336. – P. 1006–1009.
40. Rancan M., Stahel P. F., Kossmann T. Inflammatory response in acute traumatic brain injury: a double-edged sword // Curr. Opin. Crit. Care. – 2002. – Vol. 8. – P. 101–105.
41. Rincon F., Ghosh S., Dey S., Maltenfort M. et al. Impact of acute lung injury and acute respiratory distress syndrome after traumatic brain injury in the United States // Neurosurgery. – 2012. – Vol. 71 – P. 795–803.
42. Rogers F. B., Shackford S. R., Trevisani G. T. et al. Neurogenic pulmonary edema in fatal and nonfatal head injuries // J. Trauma. – 1995. – Vol. 16. – P. 860–866.
43. Sarnoff S. J., Sarnoff L. C. Neurohemodynamics of pulmonary edema. II. The role of sympathetic pathways in the elevation of pulmonary and stemic vascular pressures following the intracisternal injection of fibrin // Circulation. – 1952. – Vol. 16. – P. 51–62.
44. Shanahan W. Acute pulmonary edema as a complication of epileptic seizures // NY Med. J. – 1908. – Vol. 37. – P. 54–56.
45. Simmons R. L., Heisterkamp C. A., Collins J. A. et al. Respiratory insufficiency in combat casualties 3. Arterial hypoxemia after wounding // Ann. Surg. – 1969. – Vol. 16. – Р. 45–52.
46. Tang B. M., Craig J. C., Eslick G. D. et al. Use of corticosteroids in acute lung injury and acute respiratory distress syndrome: a systematic review and metaanalysis // Crit. Care Med. – 2009. – Vol. 37. – P. 1594–1603.
47. Theodore J., Robin E. D. Speculations on neurogenic pulmonary edema (NPE) // Am. Rev. Respir. Dis. – 1976. – Vol. 113. – P. 405–411.
48. van der Zee H., Malik A. B., Lee B. C. et al. Lung fluid and protein exchange during intracranial hypertension and role of sympathetic mechanisms // J. Appl. Physiol. Respir. Environ Exerc. Physiol. – 1980. – Vol. 48. – P. 273–280.
49. Wagle V. G., Hall A., Voytek T. et al. Aqueductal (pencil) glioma presenting as neurogenic pulmonary edema: a case report // Surg. Neurol. – 1990. – Vol. 34. – P. 435–438.
50. Wayne S. L., O’Donovan C. A., McCall W. V., Link K. Postictal neurogenic pulmonary edema: experience from an ECT model // Convuls. Ther. – 1997. – Vol. 13. – P. 181–184.
51. Wohns R. N., Tamas L., Pierce K. R. et al. Chlorpromazine treatment for neurogenic pulmonary edema // Crit. Care Med. – 1985. – Vol. 16. – P. 210–211.
52. Wray N. P., Nicotra M. B. Pathogenesis of neurogenic pulmonary edema // Am. Rev. Respir. Dis. – 1978. – Vol. 16. – P. 783–786.
53. Wu S., Fang C. X., Kim J. et al. Enhanced pulmonary inflammation following experimental intracerebral hemorrhage // Exp. Neurol. – 2006. – Vol. 200. – P. 245–249.
54. Young N., Rhodes J. K., Mascia L. et al. Ventilatory strategies for patients with acute brain injury // Curr. Opin. Crit. Care. – 2010. – Vol. 16, № 1. – P. 45–52.
Источник
