Механизм франка старлинга при отеках
Согласно классической теории Э. Старлинга (1896), нарушение обмена воды между капиллярами и тканями определяется следующими факторами: 1) гидростатическим давлением крови в капиллярах и давлением межтканевой жидкости; 2) коллоидноосмотическим давлением плазмы крови и тканевой жидкости; 3) проницаемостью капиллярной стенки.
Кровь движется в капиллярах с определенной скоростью и под определенным давлением (рис. 12-45), в результате чего создаются гидростатические силы, стремящиеся вывести воду из капилляров в интерстициальное пространство. Эффект гидростатических сил будет тем больше, чем выше кровяное давление и чем меньше величина давления тканевой жидкости. Гидростатическое давление крови в артериальном конце капилляра кожи человека составляет 30-32 мм рт.ст., а в венозном конце — 8-10 мм рт.ст.
Установлено, что давление тканевой жидкости является величиной отрицательной. Она на 6-7 мм рт.ст. ниже величины атмосферного давления и, следовательно, обладая присасывающим эффектом действия, способствует переходу воды из сосудов в межтканевое пространство.
Таким образом, в артериальном конце капилляров создается эффективное гидростатическое давление(ЭГД) — разность между гидростатическим давлением крови и гидростатическим давлением межклеточной жидкости, равное ~ 36 мм рт.ст. (30 — (-6)). В венозном конце капилляра величина ЭГД соответствует 14 мм рт.ст.
(8 — (-6)).
Удерживают воду в сосудах белки, концентрация которых в плазме крови (60-80 г/л) создает коллоидно-осмотическое давление, равное 25-28 мм рт.ст. Определенное количество белков содержится в межтканевых жидкостях. Коллоидно-осмотическое
Обмен жидкости между различными частями капилляра и тканью (по Э. Старлингу): pa — нормальный перепад гидростатического давления между артериальным (30 мм рт.ст.) и венозным (8 мм рт.ст.) концом капилляра; bc — нормальная величина онкотического давления крови (28 мм рт.ст.). Влево от точки A (участок Ab) происходит выход жидкости из капилляра в окружающие ткани, вправо от точки А (участок Ac) происходит ток жидкости из ткани в капилляр (А1 — точка равновесия). При повышении гидростатического давления (p’a’) или снижении онкотического давления (b’c’) точка A смещается в положение А1 и А2. В этих случаях переход жидкости из ткани в капилляр затрудняется и возникает отек
давление интерстициальной жидкости для большинства тканей составляет ~ 5 мм рт.ст. Белки плазмы крови удерживают воду в сосудах, белки тканевой жидкости — в тканях. Эффективная онкотическая всасывающая сила(ЭОВС) — разность между величиной коллоидно-осмотического давления крови и межтканевой жидкости. Она составляет ~ 23 мм рт. ст. (28-5). Если эта сила превышает величину эффективного гидростатического давления, то жидкость будет перемещаться из интерстициального пространства в сосуды. Если ЭОВС меньше ЭГД, обеспечивается процесс ультрафильтрации жидкости из сосуда в ткань. При выравнивании величин ЭОВС и ЭГД возникает точка равновесия А (см. рис. 12-45).
В артериальном конце капилляров (ЭГД = 36 мм рт.ст., а ЭОВС = 23 мм рт.ст.) сила фильтрации преобладает над эффективной онкотической всасывающей силой на 13 мм рт.ст. (36-23). В точке равновесия А эти силы выравниваются и составляют 23 мм рт.ст. В венозном конце капилляра ЭОВС превосходит эффективное гидростатическое давление на 9 мм рт.ст. (14 — 23 = -9), что определяет переход жидкости из межклеточного пространства в сосуд.
По Э. Старлингу, имеет место равновесие: количество жидкости, покидающей сосуд в артериальной части капилляра, должно быть равно количеству жидкости, возвращающейся в сосуд в венозном конце капилляра. Как показывают расчеты, такого равновесия не происходит: сила фильтрации в артериальном конце капилляра равна 13 мм рт.ст., а всасывающая сила в венозном конце капилляра -9 мм рт.ст. Это должно приводить к тому, что в каждую единицу времени через артериальную часть капилляра в окружающие ткани жидкости выходит больше, чем возвращается обратно. Так оно и происходит — за сутки из кровяного русла в межклеточное пространство переходит около 20 л жидкости, а обратно через сосудистую стенку возвращается только 17 л. Три литра транспортируется в общий кровоток через лимфатическую систему. Это довольно существенный механизм возврата жидкости в кровяное русло, при повреждении которого могут возникать так называемые лимфатические отеки.
Источник
Преднагрузка и постнагрузка на сердце. Механизм Франка-Старлинга
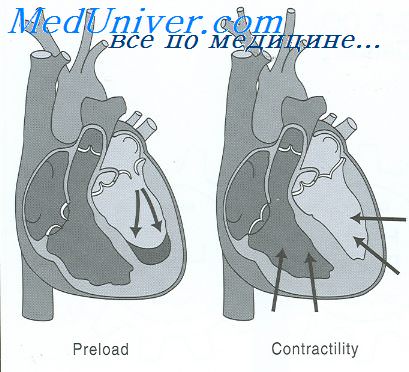
Оценивая сократительные свойства мышцы, очень важно определить степень напряжения мышцы перед началом сокращения (так называемую преднагрузку), а также нагрузку, которую мышце предстоит преодолеть, развивая сокращение (так называемую постнагрузку).
Для сердца преднагрузка определяется величиной конечно-диастолического давления, когда наполнение желудочков кровью завершилось.
Постнагрузка желудочка определяется величиной давления в артерии, берущей начало от данного желудочка. На рисунке это соответствует систолическому давлению во время фазы III диаграммы «объем-давление». (Иногда постнагрузка несколько вольно определяется как сосудистое сопротивление, а не давление в сосудах.)
Понятия преднагрузки и постнагрузки имеют большое практическое значение: нарушение функции сердечно-сосудистой системы может протекать с резкими изменениями как преднагрузки или постнагрузки, так и обоих этих факторов одновременно.
Потребление кислорода сердцем. Сердечная мышца, так же как и скелетная мышца, использует химическую энергию для сократительной деятельности. Энергия освобождается главным образом при окислении жирных кислот и в меньшей степени — при окислении других субстратов, таких как лактат и глюкоза. Таким образом, уровень потребления кислорода сердечной мышцей является основным показателем энергетического обеспечения деятельности сердца.
Эффективность сердечных сокращений. В процессе сокращения сердечной мышцы большая часть освободившейся химической энергии превращается в тепло, а меньшая часть энергии затрачивается на совершение работы. Отношение рабочих энерготрат к общему количеству выделенной энергии характеризует эффективность сердечных сокращений, или коэффициент полезного действия сердца. КПД сердца здоровых людей составляет примерно 20-25%. В случае сердечной недостаточности этот показатель может уменьшаться до 5-10%.
В условиях покоя сердце перекачивает от 4 до 6 л крови в минуту. При тяжелой физической нагрузке сердцу необходимо перекачивать в 4-7 раз больше крови, чем в покое. Такому усилению сердечной деятельности способствуют: (1) внутрисердечные механизмы, регулирующие насосную функцию в зависимости от объема притекающей к сердцу крови; (2) центральные нервные механизмы, контролирующие частоту и силу сердечных сокращений с участием автономной (вегетативной) нервной системы.
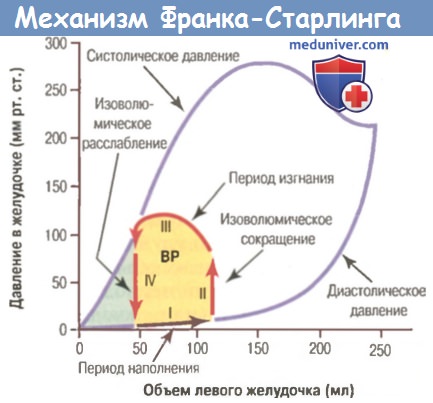
Связь между объемом левого желудочка и внутрижелудочковым давлением во время диастолы и систолы называемтся механизмом Франка-Старлинга.
Красными стрелками показана рабочая диаграмма «объем-давление» (изменение внутрижелудочкового объема и давления в течение сердечного цикла).
ВР — внешняя работа
Механизм Франка-Старлинга
Нам известно, что в разных ситуациях объем крови, который сердце перекачивает за минуту, почти полностью определяется венозным возвратом, т.е. объемом крови, поступающим в сердце из вен. Это можно объяснить следующим образом: кровоток каждого отдельного органа контролируется местными механизмами в зависимости от метаболических потребностей данного органа; кровь, оттекающая от отдельных органов, сливается в общую венозную систему и поступает к сердцу; сердце, в свою очередь, автоматически перекачивает всю поступившую к нему кровь в артериальное русло, снабжая периферические органы, и т.д.
Способность сердца адаптироваться к увеличению объема поступающей к нему крови называют внутрисердечным механизмом Франка—Старлинга, названным в честь выдающихся физиологов прошлого века. Суть механизма в следующем: чем больше степень растяжения миокарда объемом притекающей крови, тем больше сила сокращения сердечной мышцы и, следовательно, тем больше объем крови, который сердце перекачивает в аорту. Другими словами, в физиологических пределах сердце перекачивает всю кровь, которая возвращается к нему по венам.
Как объяснить механизм Франка-Старлинга? Когда избыточный объем крови поступает в желудочки, волокна сердечной мышцы растягиваются. Нити актина и миозина в миофибриллах занимают положение, близкое к оптимальному для развития большей силы сокращения. Таким образом, желудочки автоматически перекачивают избыточный объем крови в артерии.
Способность мышечных волокон, растянутых до оптимальной длины, сокращаться с большей эффективностью характерна для всех поперечнополосатых мышц, а не только для миокарда.
Усиление насосной функции сердца при увеличении венозного возврата происходит и по другой причине. Растяжение стенки правого предсердия приводит к увеличению частоты сердечных сокращений на 10-20%, что тоже вносит вклад в увеличение выброса крови из желудочков в артерии.
— Также рекомендуем «Внешняя регуляция насосной функции сердца. Вегетативная регуляция сердца»
Оглавление темы «Сердечная мышца. Сократительная функция мышцы сердца»:
1. Сердечная мышца. Физиология сердечной мышцы
2. Потенциал действия сердечной мышцы. Скорость проведения импульса в сердечной мышце
3. Связь между возбуждением и сокращением сердца. Роль ионов кальция в сокращении сердца
4. Сердечный цикл. Связь электрокардиограммы и сердечного цикла
5. Насосная функция желудочков. Функции желудочков сердца
6. Функция и физиология клапанов сердца. Кривая аортального давления
7. Насосная функция сердца. Оценка насосной функции сердца
8. Преднагрузка и постнагрузка на сердце. Механизм Франка-Старлинга
9. Внешняя регуляция насосной функции сердца. Вегетативная регуляция сердца
10. Влияние калия и кальция на сердце. Влияние температуры тела на сердце
Источник
Регуляция сердечного выброса. Механизм Франка-СтарлингаКогда утверждают, что сердечный выброс регулируется венозным возвратом, это значит, что само сердце не является главным в регуляции сердечного выброса. Наоборот, многочисленные факторы, которые влияют на периферическое кровообращение и обеспечивают приток крови к сердцу из вен (т.е. венозный возврат) у играют главную роль в регуляции сердечного выброса. Почему периферические факторы являются более важными в регуляции сердечного выброса, чем само сердце? Дело в том, что в сердце имеется собственный «встроенный» механизм, позволяющий ему автоматически перекачивать то количество крови, которое поступает в правое предсердие из вен. Этот механизм называют законом сердца Франка-Старлинга. В соответствии с этим законом увеличение объема крови, поступающей к сердцу, приводит к растяжению камер сердца, что, в свою очередь, вызывает увеличение силы сердечных сокращений. В результате больший, чем раньше, объем крови поступает из сердца в большой круг кровообращения. Таким образом, вся кровь, притекающая к сердцу, без промедления автоматически перекачивается в аорту — и опять циркулирует в сосудистом русле. Другим важным фактором является увеличение частоты сердечных сокращений в ответ на растяжение миокарда. Так, растяжение стенки правого предсердия в области синусного узла непосредственно влияет на возбудимость пейсмекерных клеток и приводит к увеличению частоты сердечных сокращений на 10-15%. Кроме того, растяжение правого предсердия вызывает рефлекторную ответную реакцию — так называемый рефлекс Бейнбриджа. Импульсы от правого предсердия направляются в сосудодвигательный центр продолговатого мозга, а затем импульсы по симпатическим и блуждающим нервам поступают к сердцу, вызывая увеличение частоты сердечных сокращений. В обычных условиях при отсутствии стрессорных факторов сердечный выброс полностью контролируется периферическими механизмами, которые определяют величину венозного возврата. Как мы увидим далее в этой главе, если объем крови, поступающей к сердцу, окажется большим, чем сердце в состоянии перекачать, именно сердце становится фактором, ограничивающим дальнейшее увеличение сердечного выброса.
Венозный возврат крови к сердцу складывается из объемного кровотока многочисленных сосудистых областей различных периферических органов и тканей. Из этого следует, что регуляция сердечного выброса является результатом регуляции местного кровотока органов и тканей местными механизмами. В большинстве тканей кровоток увеличивается пропорционально увеличению их метаболических потребностей. Например, местный кровоток обычно увеличивается, когда увеличивается потребление кислорода тканями. Обратите внимание, что при увеличении физической нагрузки параллельно увеличиваются и потребление кислорода, и сердечный выброс. Итак, сердечный выброс зависит от суммарного действия многочисленных факторов, контролирующих местный кровоток во всех органах и тканях. Кровоток всех органов и тканей формирует венозный возврат крови к сердцу. Сердце автоматически перекачивает в артерии всю поступившую кровь — и она вновь направляется в сосудистую систему периферических органов и тканей. Обратите внимание, что при нормальном периферическом сопротивлении (отметка 100% на оси абсцисс) сердечный выброс тоже нормальный. Затем, когда периферическое сопротивление увеличивается, сердечный выброс падает; и наоборот, когда периферическое сопротивление уменьшается, сердечный выброс растет. Это легко понять, если обратиться к одному из выражений закона Ома: Сердечный выброс = Артериальное давление/Общее периферическое сопротивление Значение этой формулы, заключается в следующем: любое изменение общего периферического сопротивления (при постоянной величине других показателей гемодинамики) приводит к изменению сердечного выброса, но в противоположном направлении. — Также рекомендуем «Увеличение сердечного выброса. Гипертрофия миокарда» Оглавление темы «Сердечный выброс. Венозный возврат»: |
Источник
Закон Франка-Старлинга
Закон Франка-Старлинга описывает механизм, который способствует поддержанию ударного объема при остром поражении миокарда и может также играть компенсаторную роль при ХСН, хотя последнее маловероятно. Нейрогуморальная активация (внешний механизм) и закон Франка-Старлинга — адаптивные явления, включающиеся в течение нескольких минут после повреждения миокарда. Поражение кардиомиоцитов приводит к резкому снижению объема крови, выбрасываемого ЛЖ (ударный объем), и последующему увеличению его КДО (и давления).
С помощью механизма Франка-Старлинга чрезмерное растяжение полости ЛЖ повышает силу сокращения кардиомиоцитов, помогая таким образом восстановить ударный объем. Этот механизм также называют законом гетерометрической ауторегуляции. В хронической ситуации задержка натрия, жидкости и сужение вен представляют собой последовательные попытки организма использовать механизм Франка-Старлинга путем увеличения наполнения ЛЖ вследствие возрастания преднагрузки.
Такие адаптивные процессы, однако, могут привести к повышению давления в системе ЛА, что способствует возникновению одышки у больных с СН. Ригидность стенок артерий большого круга кровообращения (сужение резистивных сосудов), возникающая в результате задержки натрия и жидкости, усиливает постнагрузку на ЛЖ, что способствует прогрессированию его недостаточности (закон гомеометрической регуляции).
Ремоделирование желудочков
Сердце пытается компенсировать увеличение преднагрузки (возникшей вследствие увеличенного объема внеклеточной жидкости и венозного притока) и постнагрузки (вследствие системного сужения артериол) различными способами. Один из них состоит в развитии гипертрофии желудочка с целью удержания систолического напряжения стенки в нормальных пределах.
Длительная перегрузка давлением, как правило, приводит к концентрической гипертрофии миокарда, тогда как перегрузка объемом обычно приводит к дилатации желудочка. Обе формы ремоделирования различаются на молекулярном уровне. Перегрузка давлением ассоциируется с параллельной репликацией миофибрилл и утолщением отдельных миоцитов. Перегрузка объемом приводит к последовательной репликации саркомеров и удлинению миоцитов. Разные типы гемодинамической перегрузки активируют различные сигнальные пути.
Результатом ремоделирования миокарда становится относительно незначительное изменение размеров, формы, функций и толщины стенок желудочка. Однако такая компенсаторная адаптация способна, по-видимому, поддерживать насосную функцию на должном уровне в течение ограниченного времени, а при продолжительном воздействии повышенной нагрузки развивается ХСН. Дилатация желудочка может привести к растяжению кольца МК и вызвать его недостаточность (рис. 1), что дополнительно увеличивает нагрузку на ЛЖ; это пример другого «порочного круга», ведущего к прогрессированию СН.

Рис. 1. Цветовое допплеровское исследование больного с регургитацией на МК, развившейся в результате дилатации ЛЖ; апикальная четырехкамерная позиция.
Первоначальное увеличение длины саркомеров, вызванное напряжением миокардиоцита, обеспечивает оптимальное перекрытие между миофиламентами. Результатом продолжающейся гемодинамической перегрузки становится снижение сократимости миокарда. У пациентов с легкой формой заболевания это проявляется уменьшением скорости сокращения миокарда или уменьшением силы изометрического сокращения. На более поздних стадиях изометрическое усилие снижается прогрессивно, уменьшаются ФВ и минутный объем сердца, что сопровождается снижением толерантности к физической нагрузке.
Мы можем лишь кратко остановиться на молекулярных механизмах, стоящих за этими изменениями, поскольку их понимание по-прежнему ограничено. Это потеря миоцитов за счет некроза и апоптоза, нарушение отношений «возбуждение-сокращение», изменения в составе внеклеточного матрикса. Потеря миоцитов в результате некроза — процесс, который происходит при ИМ, дилатационной кардиомиопатии или миокардите, в последних случаях он носит диффузный характер. Апоптоз, или запрограммированная смерть клетки, возникает в результате запуска генетической программы, ведущей к деградации ядерной ДНК.
В недавних исследованиях в миокарде больных с СН описаны апоптические клетки. Некоторые вещества, такие как ангиотензин II, активные формы кислорода, оксид азота (NO) и провоспалительные цитокины, могут в эксперименте вызывать апоптоз кардиомиоцитов. Однако его роль при ХСН достоверно неизвестна. Изменения внеклеточного матрикса проявляются увеличением содержания коллагена. Наряду с этим может быть повышена его деградация, а также синтез и активность ферментов, контролирующих эти процессы. Изменение содержания коллагена может способствовать нарушению систолического сокращения, но еще большее значение оно имеет для уменьшения эластичности желудочка и нарушения его наполнения.
John McMurray, Mark Petrie, Karl Swedberg, Michel Komajda, Stefan Anker и Roy Gardner
Сердечная недостаточность
Опубликовал Константин Моканов
Источник
