Инфузионная терапия при отеке мозга
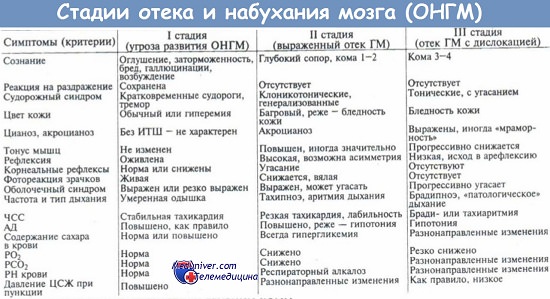
Отек головного мозга представляет собой универсальный неспецифический патогенетический синдром, связанный с нарушением мозговой перфузии и с острой внутричерепной гипертензией (ВЧГ).
Патогенез этого состояния представляет собой избыточное накопление жидкости в клеточном и интерстициальном пространствах головного мозга. Преобладание внутриклеточной гипергидратации характеризуется как отек, а внеклеточной – как набухание мозга. Оба эти процесса, как правило, развиваются одновременно, поэтому обычно говорят об отеке-набухании головного мозга.
Ткань головного мозга отделена от просвета сосудов гемато-энцефалическим барьером (ГЭБ). Эндотелиальные клетки сосудов мозга плотно прилегают друг к другу. Церебральные капилляры имеют эффективные поры, они предупреждают прохождение плазменных белков и относительно непроходимы для ионов натрия, калия, хлора и свободно проходимы для воды. Натрий создает по ходу барьера осмотический градиент. Снижение концентрации натрия в плазме снижает осмолярность плазмы и увеличивает содержание воды в мозговой ткани. Наоборот, острое увеличение концентрации натрия в плазме ведет к увеличению ее осмолярности и заставляет часть воды перейти из тканей мозга в просвет сосудов. Это делает мозг исключительно чувствительным осмометром: содержание воды в мозге меняется даже при небольших сдвигах системной осмолярности. Повреждение ГЭБ делает невозможным поддержание ни онкотического, ни осмотического градиента.
Нормальное функционирование головного мозга определяется ауторегуляцией мозговых сосудов, от которой зависит поступление к нему энергетических субстратов и кислорода. При отеке головного мозга регуляторный механизм нарушается, в результате чего кровоснабжение мозга становится зависимым от церебрального перфузионного давления (ЦПД).
Церебральное перфузионное давление (ЦПД) – равно разнице между средним артериальным давлением (САД) и внутричерепным давлением (ВЧД), измеренных в одних единицах (мм рт. ст.).
САД является важнейшим фактором, определяющим адекватную перфузию внутренних органов.
САД=АДсист. + 2АДдиаст./3
Внутричерепное давление (ВЧД) в норме составляет 0-15 мм рт.ст у детей и 8-10 мм рт.ст. у взрослых. При остром повышении ВЧД возможно развитие признаков вклинения мозга с наступлением смерти.
Задачи инфузионной терапии при отеке головного мозга:
1. Поддержание нормальной осмолярности и водно-электролитного баланса в режиме умеренной дегидратации путем ограничения объема вводимой жидкости.
2. Поддержание нормоволемии и гемодинамики.
3. Создание терапевтической гемодилюции для обеспечения эффективного мозгового кровообращения и микроциркуляции.
4. Восполнение энергозатрат (при стойких судорогах, длительной гипертермии потребность в энергетических субстратах возрастает на 50-70%.
Современные принципы ведения больных с ВЧГ, основанные на принципах регуляции объема и оптимизации церебральной микроциркуляции, получившие название «Лундской терапии», включают изоволемию, изоосмолярность, изоонкотический режим.
Выбор стартового раствора при отеке головного мозга определяется тяжестью состояния больного и общей осмолярностью.
· Маннитол 10-15-20% раствор применяют при угрозе или развитии дислокации головного мозга, при гипоосмолярности ≤ 260 мосм/л.
Осмолярность 20% раствора составляет 1039-1130мосм/л, рН 4,0-6,5. Экскретируется с мочой в неизменном виде до 80% за первые сутки, 10% метаболизируется в гликоген и оставшиеся 10% выводятся на 2-е сутки. Повышает осмотическое давление плазмы крови и, как следствие, уменьшает объем внутри- и вне клеточной жидкости головного мозга путем ее перемещения в плазму за счет экстракции воды из тех участков мозга, где ГЭБ еще сохранен. Это приводит к снижению ВЧД уже через 15-30 минут. В интерстиций при ненарушенном транскапиллярном обмене переходит малое количество препарата, а внутрь клетки через клеточную мембрану маннитол не проникает вовсе. Препарат обладает выраженным диуретическим эффектом, снижает реабсорбцию натрия и воды в почечных канальцах.
Эффекты маннитола:
-снижение ВЧД и уменьшение отека головного мозга на 15-25%;
-снижение ликворопродукции;
-улучшение мозгового кровотока на 10-15%;
-повышение ОЦК и ЦВД;
-повышение САД;
-улучшение реологических свойств крови;
-антиоксидантный;
-диуретический.
Недостатки маннитола:
-развитие гипонатриемиии и гипохлоремии;
-снижение онкотического давления плазмы крови за счет гемодилюции;
-возможно транзиторное увеличение внутричерепного объема крови за счет вазодилатирующего эффекта и, как следствие, повышение ВЧД;
-развитие «феномена отдачи» — возможен при нарушениях транскапиллярного обмена на уровне ГЭБ при длительном применении высоких доз маннитола (1-2г/кг). Осмотически активные вещества перемещаются в межклеточное пространство и усиливают его гипергидратацию, вызывая вторичное повышение ВЧД. Клинически «феномен отдачи» проявляется нарастанием клиники отека головного мозга через 2-3 часа после инфузии.
· Гипертонический раствор 3-7,5% физиологического раствора хлорида натрия при гипоосмолярности действует аналогично манниту, особенно при сочетании отека головного мозга и артериальной гипотензии.
· Коллоидные растворы показаны при гиповолемиии с гипотензией.
Гипотонические и гипоосмолярные растворы противопоказаны!
Рекомендуемые страницы:
Источник
Оглавление темы «Отек мозга. Первая помощь при отеке головного мозга. Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Первая помощь при миастеническом кризе.»: Лечение при отеке мозга. Лечение отека головного мозга в стационаре.Данный вид медицинской помощи должен осуществляться в отделениях реанимации и интенсивной терапии и быть построен на нижеприведенных принципах лечения отека головного мозга (Ш. Ш. Шамансуров и др., 1995). Коррекция нарушения дыхания и сердечной деятельности. В зависимости от степени поражения ЦНС и тяжести состояния больных с тяжелыми формами отека, нарушения дыхания и сердечной деятельности могут быть первичными и вторичными. При их коррекции используются стандартные методики. Этиологическое лечение основного заболевания. Рациональное лечение отека мозга заключается в устранении самой причины, которая этот отек вызвала. Такое лечение возможно лишь тогда, когда первопричина отека точно известна. Однако даже устранение причины отека не обязательно приводит к его ликвидации. В таких случаях терапевтические воздействия необходимо направить на сам отек мозга. Следует указать, что ни один метод лечения не устранит отек вокруг опухоли, абсцесса или гематомы, если не ликвидирован первичный патологический очаг. Патогенетическая терапия отека направлена, в первую очередь, на устранение гипоксии как наиболее неблагоприятного фактора, способствующего развитию отека. Эта терапия направлена на нормализацию гемодинамики, ликвородинамики, метаболизма нейронов. Иными словами, терапия нацелена на коррекцию основных патофизиологических механизмов (циркуляторных, васкуляторных, тканевых), участвующих в развитии отека мозга. Коррекция гематоциркуляторных нарушений включает: При коррекции васкулярного (барьерного) фактора назначают следующие препараты: Иммуностимулирующая терапия включает применение тимозина, Т-активина, В-активина, тимогена, левамизола, пропермила, витаминов группы В. Коррекция тканевого фактора включает: Коррекция нарушений водно-электролитного обмена и дегидратационная терапия. Важным патогенетическим направлением лечения отека мозга является назначение дегидратационной терапии: Хирургическая коррекция отека мозга. Когда этиологический фактор отека мозга представлен экспансивным процессом (гематома, опухоль, абсцесс и т. д.), он может быть прерван только с помощью нейрохирургического вмешательства.
— Также рекомендуем «Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Причины ( этиология ) миастении. Патогенез миастении.» |
Источник
К.Томмасино
Отд.анестезиологии клиники Сан-Рафаэль, Милан, Италия
Существующая в настоящее время практика ограничения жидкости применительно к пациентам с патологией мозга базируется на простом предположении, что в/в введение жидкости может усилить отек мозга. Однако, ограничение жидкости ведет к гиповолемии, гемодинамической нестабильности и может оказывать отрицательный эффект на церебральную перфузию. Лишь небольшое количество данных в отношении влияния инфузионных растворов на мозг, полученных в исследовании у больных, может служить основанием для выработки рационального подхода в проведении инфузионной терапии у больных с пораженным мозгом [1]. Тем не менее, возможно проанализировать те факторы, которые определяют жидкостные перемещения в мозге и на этом основании попытаться выработать обоснованные рекомендации.
Осмотическое давление. Это гидростатическая сила действующая в направлении уравновешивания концентраций с помощью перемещения воды по обе поверхности мембраны, которая непроницаема для веществ растворенных в воде.
Осмолярность и осмоляльность. Для подавляющего большинства солевых растворов осмоляльность (молярное количество осмотически активных частиц на килограмм растворителя) равна или чуть меньше осмолярности (молярное количество осмотически активных частиц на литр раствора). Так например, раствор Рингер-лактата имеет расчетную осмолярность около 275 мосм/л, а измеренную прямым методом осмоляльность около 254 мосм/кг Н2О [2].
Коллоидно-онкотическое давление (КОД). Осмоляльность и осмолярность определяются общим количеством растворенных частиц в растворе, вне зависимости от их величины. КОД является частью общей осмоляльности создаваемой крупными (например белковыми) молекулами.
Уравнение Старлинга описывает соотношение сил вызывающих перемещение воды через сосудистую мембрану. В простом виде перемещение жидкости является пропорциональным величине градиента гидростатического давления минус осмотический и плюс онкотический градиенты. На переферии эндотелий капилляров имеет поры размером 65 А и они свободно проницаемы как для малых молекул, так и для ионов (Na+, Cl-), но не для больших молекул, таких как молекулы белков (Рисунок 1).
Головной мозг, однако, существенно отличается в этом отношении от переферии, что диктует необходимость переоценки уравнения Старлинга для мозга.
Гемато-Энцефалический барьер (ГЭБ). Эндотелиальные клетки сосудов мозга плотно соприкасаются друг с другом без каких-либо промежутков. Эффективные поры в церебральных капиллярах достигают всего 7 А, делая эту уникальную структуру непроницаемой для больших молекул, относительно непроницаемой для ионов и свободно проходимой для воды (Рисунок 2).
Это делает мозг исключительно чувствительным осмометром: содержание воды в мозге может меняться даже при небольших сдвигах системной осмоляльности, но остается неизменным даже при значительных колебаниях КОД [3-5]. Если же ГЭБ открыт, это делает невозможным поддержание ни осмотического ни онкотического градиента. В большинстве клинических ситуаций отек мозга развивается вторично вследствие травмы, но при этом сдвиги КОД все же не вызывают каких-либо дополнительных изменений [6-8].
ИНФУЗИОННАЯ ТЕРАПИЯ:
«благоразумные» рекомендации.
Ограничение жидкости.
Клинически применяемое ограничение жидкости оказывет лишь незначительный эффект на развитие отека [9;10]. Тем не менее, некоторые логические предпосылки к применению умеренного ограничения жидкости могут быть найдены в работе Shenkin et al. [11]: у больных получавших стандартную поддерживающую инфузионную терапию (2000 мл/день 0,45% раствора NaCl с 5% декстрозой) развивалось прогрессивное снижение осмоляльности плазмы крови, в то время как у пациентов, которые получали эту же инфузионную терапию в половинном объеме этих изменений осмоляльности не отмечалось. В этом свете ограничение жидкости может рассматриваться как «превентивное» средство от развития гипоосмоляльного отека. Это отнюдь не означает, что большая степень жидкостного ограничения является еще более эффективной, или же что применение инфузионных растворов, которые не снижают осмоляльность плазмы крови является опаным в отношении увеличения отека.
Восполнение объема/ волюмоэкспансия/ реанимация.
Ни восполнение объема, ни волюмоэкспансия не оказывает отрицательного эффекта на отек мозга, до тех пор пока осмоляльность поддерживается в неизменных пределах и до тех пор пока гидростатическое давление в церебральных капилярах не возрастет существенно. Будут достигнуты эти эффекты с помощью коллоидных и кристаллоидных инфузионных растворов — не суть важно, а вот осмоляльность отдельных использованных инфузионных сред является принципиальной. У больных с субарахноидальным кровоизлиянием и вазоспазмом использование гидроксиэтилкрахмала, в особенности в повторных дозах, может вызвать проблемы с гемостазом. Введения жидкостей, которые приводят к снижению осмоляльности плазмы крови вообще следует избегать. Маловероятно, что небольшие объемы раствора Рингер-Лактата (1-3 литра) окажут выраженный отрицательный эффект. Если требуются большие объемы инфузионных растворов, по-видимому, целесообразней использовать более изотонические жидкости. Однако, это не следует расценивать как рекомендацию «вводить больному столько изотонических растворов, сколько хочется». Объемная перегрузка может оказывать свой отрицательный эффект на состояние интракраниальной системы следующим образом — через увеличение ВЧД из-за увеличения внутричерепного объема крови или через нарастание отека мозга из-за увеличения гидростатического градиента в сосудах.
В послеоперационном периоде у нейрохирургических больных применение больших объемов инфузионных растворов обычно не требуется. В таких случаях рекомендации Shenkin et al. [11] (т.е. примерно 1000 мл/день) представляются обоснованными. Есди все же отек мозга нарастает, дальнейшее ограничение жидкости вряд ли даст положительный эффект, но может привести к гиповолемии.
ДРУГОЕ.
Диуретики.
Маннитол остается до сих пор ведущим диуретиком, используемым для снижения повышенного внутричерепного давления или обеспечения его податливости (релаксации) при интракраниальных вмешательствах. Его эффект реализуется за счет экстракции воды из тех участков мозга, где ГЭБ относительно сохранен. Маннитол может вызывать транзиторное увеличение внутричерепного объема крови (реализуется за счет вазодилятирующего эффекта присущего всем гиперосмоляльным растворам) и, соответственно, ВЧД. Интересно, что этот феномен редко наблюдается в присутствии внутричерепной гиперетензии [12] или когда маннитол вводится с небольшой скоростью. При использовании маннитола в повторных дозах он может накапливаться в межклеточном пространстве мозга, а следствием этого может быть формирование обратного осмотического градиента с итогом в виде усугубления отека. Особого внимания заслуживает чрезмерное и/или повторное применение маннитола, так как чрезмерная гиперосмоляльность является угрожающим жизни состоянием.
Фуросемид и другие так называемые петлевые диуретики могут оказывать свой эффект непосредственно уменьшая отек клеток, и этот механизм является более вероятным чем вторичный эффект, опосредуемый через уменьшение объема экстрацеллюлярной жидкости. В настоящее время имеются убедиельные данные в пользу выраженного синергизма фуросемида и маннитола: эти два препарата совместно имеют наиболее выраженный эффект на ВЧД. Диурез при использовании этой комбинации всегда существенно выше, а следовательно и частота электролитных нарушений так же высока. Наилучшими кандидатами для такой комбинации являются пациенты с застойной сердечной недостаточностью, у которых волюмоэкспансия, вызываемая маннитолом может быть связана с опасностью декомпенсации.
Гипертонический солевой раствор.
Гипертонические солевые растворы являются эффективными при проведении интенсивной инфузионной терапии, при реанимации и при их использовании наблюдается намного менее выраженный отек мозга и/или повышение ВЧД [13;14]. Недавно мы показали, что 7,5% гипертонический раствор NaCl является столь же эффективным, сколь и 20% раствор маннитола в снижении выбухания мозга и ВЧД во время нейрохирургических вмешательств. Однако, если учесть вероятность развития возможных отрицательных эффектов (прежде всего гипернатриемии), применение гипертонического раствора NaCl не имеет существенных преимуществ перед использованием маннитола при плановых нейрохирургических вмешательствах [15].
Глюкоза.
Тот факт, что гипергликемия развивающаяся перед ишемическим инсультом может существенно ухудшать неврологические исходы [16], позволяет рекомендовать ограничение применения растворов содержащих глюкозу у пациентов с пораженным мозгом. Более того, применение содержащих глюкозу растворов ведет к выделению осмотически свободной воды по мере метаболизации глюкозы, что проявляется снижением осмоляльности и формированием отека во всех тканях, включая и мозг.
Л И Т Е Р А Т У Р А:
1. Tommasino C., Todd M.M. Fluid management in neurosurgical patients.//
In:Van Aken (Ed). Fundamentals for neuroanaesthetic practice. BMJ. London. p. 133-149.
2. Tommasino C., Moore S., Todd M.M. Cerebral effects of isovolemic hemodilution with crystalloid or colloid solutions.// Crit. Care Med. 1988. V. 16 p. 862 — 868.
3. Todd M.M., Tommasino C., Moore S. Cerebral effects of isovolemic hemodilution with a hypertonic saline solution.// J. Neurosurg. 1985. V. 63 p. 944 — 948.
4. Zornow M.H., Todd M.M., Moore S.S. The acute cerebral effects of changes in plasma osmolality and oncotic prassure.// Anesthesiology. 1987. V. 67 p. 936 — 941.
5. Hindman B.J., Funatsu N., Cheng D.C.H., et al. Differential effect of oncotic pressure on cerebral and extracerebral water content during cardiopulmonary bypass in rabbits.// Anesthesiology. 1990. V. 73 p. 951 — 957.
6. Kaieda R., Todd M.M., Cook L.N., et al. Acute effects of changing plasma osmolality and colloid oncotic pressure on formation of brain edema after cryogenic injury.// Neurosurgery. 1989. V. 24 p. 671 — 678.
7. Kaieda R., Todd M.M., Warner D.S. Prolonged reduction in colloid oncotic pressure does not increase brain edema following cryogenic injury in rabbits.// Anesthesiology. 1989. V. 71 p. 554 — 560.
8. Zornow M.H., Scheller M., Todd M.M., et al. Acute cerebral effects of isotonic crystalloid and colloid solutions following cryogenic brain injury in the rabbit.// Anesthesiology. 1988. V. 69 p. 185 — 191.
9. Morse M.L., Milsten J.M., Haas J.E., et al. Effect of hydration on experimentally induced cerebral edema.// Crit. Care Med. 1985. V. 13 p. 563 — 565.
10. Tauber M.G., Sande E., Fournier M.A., et al. Fluid administration, brain edema, and cerebrospinal fluid lactate and glucose concentrations in experimental Escherichia coli meningitis.// J. Infect. Dis. 1993. V. 168 p. 473 — 476.
11. Shenkin H.A., Benzier H.O., Bouzarth W. Restricred fluid intake: Rational management of the neurosurgical patients.// J. Neurosurg. 1976. V. 45 p. 432 — 436.
12. Ravussin P., Abou-Madi M., Archer D., et al. Changes in CSF pressure after mannitol in patients with and without elevated CSF pressure.// J. Neurosurg. 1988. V. 69 p. 869 — 876.
13. Gunnar W.P., Merlotti G.J., Jonasson O., et al. Resuscitation from hemorrhagic shock.// Ann. Surg. 1986. V. 204 p. 686 — 692.
14. Prough D.S., Whitley J.M., Taylor C.L., et al. Regional cerebral blood flow following resuscitation from hemorrhagic shock with hypertonic saline.// Anesthesiology. 1991. V. 75 p. 319 — 327.
15. Gemma M., Cozzi S., Tommasino C., et al. 7,5% Hypertonic saline versus 20% mannitol during elective neurosurgical supratentorial procedures.// J. Neurosurg. Anesthesiol. 1997. V. 9 p. 329 — 334.
16. Weir C.J., Murray G.D., Dyker A.G., et al. Is hyperglycaemia an indipendent predictor of poor outcome after acute stroke? Results of a long term follow up study.// Brit. Med. J. 1997. V. 314 p. 1303 — 1306.
(Visited 25 times, 1 visits today)
Источник
