Протокол лечения отека мозга у детей
Цели лечения: целью терапии должна быть гарантия достаточного локального и системного контроля.
Тактика лечения
Немедикаментозное лечение: режим и диета по тяжести состояния пациента.
Локальная и региональная терапия: базисной терапией является первичная резекция, а также краниоспинальное облучение локального объёма опухоли и облучение спинного мозга при медуллобластоме с лечебно-профилактической целью.
Хирургическое лечение
Нейрохирургическая терапия: для детей с медуллобластомой, у которых опухоль способствует нарушению циркуляции ликвора, создавая угрозу для жизни, первичная резекция, прежде всего, имеет жизнеспасающее значение. Если путем операции микроскопически подтверждаемая тотальная резекция выполнена, ребёнок без остаточной опухоли имеет самый низкий риск рецидива. Например, при инфильтрации ядер моста, мозжечка или среднего мозга тотальная резекция без риска непреходящих неврологических нарушений невозможна. Применение пассажного дренажа в отдельных случаях может быть показано в качестве первичной меры.
Оценка объёма операции: оценивается с помощью нейрохирургического протокола операции (критерий S) и послеоперационного радиологического обследования (R), выполненного в первые 24-48 часов после операции.
S1 – полное удаление.
S2 – резидуальная опухоль < 1,5 см, возможна локальная инвазия.
S3 – резидуальная опухоль > 1,5 см.
S4 – большая остаточная опухоль (биопсия).
Объём операции оценивают с помощью КТ/МРТ с КУ, выполненные через 24-48 часов после операции:
R1 – нет признаков опухоли.
R2 – краевой захват контраста.
R3 – видимая остаточная опухоль.
R4 – нет значительных изменений по сравнению с предоперационными КТ/МРТ.
Оценка объёма операции осуществляется как по протоколу, так и КТ/МРТ:
S1 и R1 – тотальное удаление.
S2 и R1-2 – субтотальное удаление.
S1-3 и R3 – частичная резекция.
S4 и R4 – биопсия опухоли.
Лучевая терапия: если медуллобластома из-за инфильтративного роста никогда не сможет быть радикально резецирована, исцеление без последующей лучевой терапии невозможно. Для каждого пациента, по меньшей мере в тех случаях, когда оккультное метастазирование в ликворные пути должно учитываться, краниоспинальное облучение общего ликворного пространства является обязательным. Доза на зону мозгового черепа и спинального канала (краниоспинальная) составляет 35-36 гр. с последующим дополнительным облучением задней черепной ямы до 20 гр. (всего=55-56 гр).
Медикаментозное лечение
Химиотерапия: т.к. посредством операции и постоперативной лучевой терапии существенного улучшения уровня выздоровления сверх 60% не наблюдается и поэтому применение химиотерапии является обязательным. Основные препараты ХТ – это препараты нитрозомочевины (CCNU, BCNU, фотемустин), темозоломид, препараты платины (цисплатин, карбоплатин) и винкристин; для неоадъювантного применения обязательными являются алкилирующие субстанции (ифосфамид, циклофосфамид), дериваты платины (цисплатин, карбоплатин), а также алкалоиды (винкристин, этопозид).
Протокол лечения с впервые выявленной медуллобластомой у детей старше 3-х лет (для группы стандартного риска)
После операции пациентам будут проводиться химиотерапия на фоне лучевой терапии, а в дальнейшем 4 цикла цикловой химиотерапии:
Операция → ЛТ + ХТ (еженедельное введение VCR и однократное введение CCNU или фотемустин) → 4 цикла ПХТ (2 цикла VCR+CPM, 2 цикла VP-16+ CDDP).
В случае прогрессирования заболевания на любом из этапов лечения терапия прерывается и больной лечится по индивидуальной схеме.
Лучевая терапия начинается на 8-21 сутки после операции. Облучение больных проводится по одинаковым схемам. Лучевая терапия проводится на гамма-аппарате или на линейном ускорителе.
На первом этапе проводится облучение всего краниоспинального пространства.
Ежедневная очаговая доза 1,8 гр. Суммарная доза на всю краниоспинальную ось при отсутствии определяемых метастазов 35 гр.
После окончания краниоспинального облучения проводится дополнительное прицельное облучение задней черепной ямки по 1,8 гр. суммарная доза на ЗЧЯ доводится до 20 гр. (всего=55 гр.).
Химиотерапия: на фоне проведения ЛТ пациентам проводится введение VCR в дозе 1,5 мг/м² поверхности тела (не более 2 мг на одно введение), внутривенно в 20,0 мл физиологического раствора. Первое введение – 7 день после начала ЛТ. Последующие введения – один раз в неделю. Всего 6 введении. Так же пациенты принимают CCNU per os в дозе 100 мг/м² поверхности тела (или фотемустин- 150 мг/м введения VCR.
Цикловая химиотерапия – после окончания химиолучевого лечения, не позднее 28 дней, начинается ХТ, который, состоит из четырёх альтернирующих циклов. Интервал между началом циклов 21 день, при условии восстановления кроветворения и удовлетворительном общем состоянии больного.
Схема цикловой химиотерапии
Цикл 1:
— винкристин — 1,5 мг/м², в/в, струйно, 1-й и 8-й дни;
— циклофосфамид – 1500 мг, в/в, капельно, за 1 час с месной; 1-й, 2-й дни;
— инфузионная терапия на фоне введения СРМ — 3000 мл/м² (5% глюкоза и физ.раствор в соотношении 1:1 с добавлением 20,0 мл 4%
раствора КСL на 500,0мл инфуз.раствора);
месна – 500 мг/м² х 3 раза, в/в, струйно (0, 4, 8 час. от начала введения СРМ).
Профилактика отёка мозга:
— дексаметазон — 0,15 мг/кг, в/в, струйно, перед началом химиотерапии;
— фуросемид — 0,5 мг/кг, за 15 минут до введения СРМ, и, если задержка жидкости составляет более 200 мл/м² поверхности тела.
Цикл 2:
— 1-я инфузия — 600 мл/м² за 6 часов: 5% глюкоза + 0,9%NaСl=1:1
+ 4,0мл 4%КСl на 100,0 мл
+ 1,2мл 20% сульфата магния на 100,0 мл
+ 2,6мл 10% глюконата кальция на 100,0 мл
+ 10мл 20% маннитола на 100,0 мл
— 2-я инфузия – 600 мл/м² за 6 часов: 5% глюкоза + 0,9% NaСl=1:1
+ 4,0мл 4% КСl на 100,0 мл
+ 1,2мл 20% сульфата магния на 100,0 мл
+ 2,6мл 10% глюконата кальция на 100,0 мл
+ 10мл 20% маннитола на 100,0 мл
40,0мл/м² 20% р-ра маннитола вводится в/в струйно перед введением цисплатина.
Цисплатин — 90 мг/м², в/в, капельно, в 100 мл/м² физ.раствора, в течении 6 часов, параллельно второй инфузии, 1 день.
Этопозид – 150 мг/м², в/в, капельно, за 1 час, в 150 мл/м² физ.раствора, до введения и начала введения маннитола, 1-3 дни.
— 3-я инфузия – 2400 млм² за 24 часа: 5% глюкоза + 0,9% NaСl=1:1
+ 4,0 мл 4% КСl на 100,0мл
+ 1,2мл 20% сульфата магния на 100,0мл
+ 2,6мл 10% глюконата кальция на 100,0мл
Профилактика отёка мозга:
— дексаметазон — 0,15 мг/кг, в/в, струйно, перед началом химиотерапии;
— фуросемид — 0,5 мг/кг, за 15 минут до введения СРМ, и если задержка жидкости составляет более 200 млм² поверхности тела.
Для группы высокого риска:
После операции пациентам группы высокого риска так же будут проводится стандартная лучевая терапия на фоне химиотерапии (аналогично как для группы стандартного риска), а в дальнейшем, через 4 недели после химиолучевого лечения будет проводиться адъюваниная химиотерапия: 8 циклов поддерживающей терапии (CCNU, CDDP, VCR).
Операция → ЛТ+ (VCR+CCNU (или фотемустин)) → 8 циклов ПХТ (CCNU (или фотемустин — 150 мг/м)
В случае прогрессирования заболевания на любом из этапов лечения терапия прерывается, и больной лечится по индивидуальной схеме.
Поддерживающая химиотерапия:
(CCNU (или фотемустин), CDDP, VCR) (VCR) (VCR) 28 дней перерыва
1 день 7 день 14 день
Вторая группа пациентов получает 8 циклов поддерживающей химиотерапии, которая начинается не позднее 28 дней после окончания химиолучевого лечения, при условии восстановления кроветворения и удовлетворительном общем состоянии больного.
Винкристин — 1,5 мг/м², в/в, струйно, в 20,0мл физ.раствора вводится в 1, 7, 14 дни.
Цисплатин — 70 мг/м², вводится в 1-й день цикла.
Инфузионные растворы (1, 2 и 3-я инфузия) и профилактика отёка головного мозга, так же, как, в группе стандартного риска.
Ломустин – 75 мг/м², перорально, 1-й день цикла (или фотемустин — 150 мг/м.
Протокол лечения больных с первично выявленными анапластическими астроцитомами и мультиформными глиобластомами у детей:
Операция → ЛТ + ХТ (темозоломид + ломустин = 1 цикл) → 6 циклов ПХТ (темозоломид + ломустин (или фотемустин — 150 мг/м).
В случае прогрессирования заболевания на любом из этапов лечения терапия прерывается, и больной лечится по индивидуальной схеме.
Лучевая терапия проводится на гамма-аппарате или линейном ускорителе спустя 2-3 недели после операции на зону опухоли с захватом здоровой ткани, отступая на 3 см от краев поражения, в СОД= 55 гр. Очаговая доза = 1,8 гр.
Одновременно с лучевой терапией в первую неделю облучения проводится один цикл ПХТ:
— темозоломид — 150 мг/м², в капсулах, перорально, с 1-го по 5-й дни;
— ломустин – 150 мг/м², 1 день, (или фотемустин — 150 мг/м.
Химиотерапия
Цикл химиотерапии начинается через 4 недели после химиолучевой терапии:
— темозоломид — 150 мг/м², в капсулах, с 1-го по 5-й дни;
— ломустин – 150 мг/м², 1 день.
Темозоломид принимается за 2 часа до ломустина.
Всего проводится 6 циклов ХТ темозоломид + ломустин после проведения химиолучевой терапии. Интервалы между циклами составляют 6 недель.
Антиэметические препараты: новабан или зофран.
Профилактика инфекции: бисептол – три раза в неделю в течение химиотерапии.
Лечебные мероприятия в рамках ВСМП:
— химиотерапия;
— лучевая терапия.
Дальнейшее ведение: после окончания лечения необходимо регулярное сканирование с целью выявления рецидивов заболевания – КТ или МРТ с контрастированием.
Оценка эффективности лечения по рекомендации ВОЗ, 1977 г.:
Купирование неврологической симптоматики, отсутствие рецидива образования либо регрессия остаточной опухоли.
Источник
Схема адъювантного лечения опухоли мозга у ребенка — Европейские протоколы
Злокачественные опухоли головного мозга являются основной причиной смерти от рака среди детей и вторым наиболее распространенным видом детского рака после лейкемии, составляя 20-25% всех раковых заболеваний у детей.
На астроцитомы приходится 52% опухолей мозга у детей, медуллобластомы/эмбриональные опухоли — 21%, эпендимомы — 10%, другие глиомы — 15%.
а) Предпосылки. Тотальное хирургическое удаление является радикальным методом при опухолях низкой степени злокачественности и обязательным условием хорошего результата для опухолей высокой степени злокачественности. Тем не менее, резекция как единственный метод редко встречается в лечебных схемах у пациентов с гистологически злокачественными новообразованиями. Адъювантное лечение, такое как химиотерапия и/или лучевая терапия, необходимо для улучшения контроля при таких заболеваниях, как медуллобластомы, эпендимомы, глиомы высокой степени злокачественности, опухоли расположенные в глубинных структурах и по средней линии, рецидивирующие или метастатические заболевания.
Несмотря на достижения в нейрохирургии, онкологии, лучевой терапии опухоли головного мозга у детей по-прежнему представляют ряд значительных терапевтических проблем:
• Внутреннее сопротивление опухоли к адъювантной терапии, включая химиотерапию и лучевую терапию.
• Недостаточная доставка лекарственных препаратов через гематоэнцефалический барьер.
• Значительная неоднородность между различными гистологическими типами одной опухоли (существует по крайней мере четыре различных типа медуллобластом).
• Преимущества потенциально лечебной лучевой терапии нивелируются значительными и неприемлемыми отдаленными последствиями.
б) Варианты адъювантной терапии опухоли мозга у ребенка:
1. Лучевая терапия опухоли мозга у ребенка. При многих опухолях ЦНС у детей лучевая терапия играет важную роль. Часто эти опухоли не могут быть радикально удалены из-за их локализации или микроскопического или макроскопического распространения. Таким образом, лучевая терапия часто применяется отдельно или как часть комбинированного подхода к лечению в сочетании с хирургическим вмешательством и/или химиотерапией. Однако обычная лучевая терапия связана с рядом побочных эффектов:
• Нейрокогнитивные и интеллектуальные расстройства.
• Потеря слуха.
• Эндокринологический дефицит по гипоталамо-гипофизарной линии (например, дефицит гормона роста).
• Потенциальное развитие второго злокачественного новообразования.
Потенциальные отдаленные интеллектуальные последствия являются серьезной проблемой для пациентов, получавших облучение ЦНС. Основными факторами риска развития когнитивных нарушений у облученных детей являются:
• Кранио-спинальное облучение (КСО): по данным исследований, менее серьезный дефицит IQ был получен у пациентов с эпендимомами, облученных только в области задней черепной ямки, чем с медуллобластомами и кранио-спинальным облучением.
• Возраст: в более молодом возрасте риск дефицита IQ выше, особенно в возрасте до трех лет.
• Снижение IQ является прогрессивным без «плато».
• Доза кранио-спинального облучения: IQ значительно нижеудетей, облученныхв стандартной дозе 35 Гр, чем в уменьшенной дозе 24 Гр.
Для того, чтобы уменьшить отдаленные последствия лучевой терапии, были разработаны методы конформной лучевой терапии, обеспечивающей подачу высокой дозы радиации на опухоль и очень маленькой дозы на соседние здоровые ткани. В эти методы входят трехмерная конформная лучевая терапия, радиохирургия и протонное облучение.
2. Химиотерапия опухоли мозга у ребенка. За последние несколько десятилетий химиотерапия была введена в схемы лечений опухолей головного мозга у детей с целью:
• Улучшения прогноза.
• Отсрочки или избежания лучевой терапии у детей раннего возраста.
• Уменьшения дозы кранио-спинального облуче-ния в Мб/ПНЭО.
Наиболее эффективными препаратами являются: соединения платины, нитрозомочевина, циклофосфамид, ингибиторы топоизомеразы, такие как СРТ-11 или этопозид, бусульфан, тиотепа и другие алкилирующие вещества, такие как темозоломид.
Для чувствительных опухолей, таких как медуллобластомы и герминоклеточные опухоли, для повышения выживаемости пациентов с высоким риском или рецидивом назначаются высокие дозы химиотерапии с последующей терапией аутологичными стволовыми клетками. Режим высоких дох химиотерапии часто основывается на сочетании двух или трех препаратов (тиотепа, мелфалан, бусульфан, карбоплатин, этопозид, циклофосфамид). Использование высоких системных доз позволяет достичь высокой концентрации их в опухоли, но с более тяжелой токсичностью.
Миелосупрессия является временной и может преодолеваться путем использования стволовых клеток, однако имеют место и другие токсичности, ограничивающие дозу, в том числе для печени, легких, почек, ЦНС, сердечно-сосудистой системы. Смертность от токсического воздействия составляет 5-10%, в основном за счет инфекций, облитерирующих заболеваний и полиорганной недостаточности.
Несмотря на то, что стандартная химиотерапия убивает большинство делящихся клеток опухоли, она абсолютно не эффективна против раковых стволовых клеток, которые обладают способностью к репарации ДНК и естественной устойчивостью к апоптозу. Следовательно, даже единичные стволовые клетки опухоли, выжившие после химиотерапии, способствуют возобновлению опухолевого роста.
Может произойти взаимодействие между противоопухолевыми препаратами и другими лекарственными средствами и развиться действие генетического полиморфизма метаболизма ферментов. Взаимодействия лекарственных препаратов способны изменять фармакокинетику химиотерапевтических агентов и существенно влиять на их эффективность или токсичность. Например, противоэпилептические и химиотерапевтические препараты имеют общие метаболические пути посредством цитохрома Р450 изоферментов (CYP).
Фенитоин, карбамазепин и фенобарбитал являются мощными индукторами CYP, которые могут привести к снижению в сыворотке крови концентрации химиотерапевтического препарата, потенциально дискредитируя противоопухолевую активность. Другие средства, такие как вальпроевая кислота, являются ингибиторами ферментов с потенциалом увеличения сывороточной концентрации противоопухолевых препаратов (например, цисплатина, нитрозомочевины). Новые противоэпилептические препараты, такие как габапентин или леветирацетам, не метаболизируют CYP и не влияют на химиотерапию.
Стероиды могут изменить состояние гематоэнцефалического барьера, ограничивая проникновение лекарственного препарата, а некоторые соединения, такие как дексаметазон, могут индуцировать CYP и изменять фармакокинетику химиотерапии.
Значительные ограничения связанны с использованием стандартных радиографических методик в качестве показателей ответа на химиотерапию опухолей головного мозга. Существует необходимость в стандартизации методологии оценки ответа опухоли на лечение. Фактически ответ может быть получен в 1D (наибольшая длина, RECIST критерий), 2D (двумерный: произведение двух перпендикулярных наибольших диаметров, критерий ВОЗ) или 3D (трехмерный: произведение двух перпендикулярных диаметров и самого длинного ортогонального диаметра этой плоскости).
Совсем недавно в клинических испытаниях изучали несколько новых классов противоопухолевых препаратов. Эти новые препараты часто действуют через разные молекулярные пути и не вызывают массовой гибели клеток, как при стандартной химиотерапии; для оценки их терапевтического эффекта следует учитывать конечные цели, такие как продолжительность ответа, 6-месячная выживаемость без прогрессирования заболевания и качество жизни.

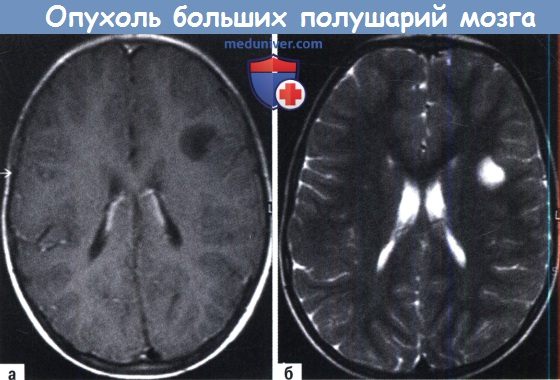
Аксиальное (А) Т1 и (Б) Т2-взвешенное изображение дисэмпбриопластической нейроэпителиальной опухоли.
Четко отграниченное образование с низкой интенсивностью сигнала на Т1-взвешенных изображениях и гиперинтенсивное на Т2.
— Также рекомендуем «Схема адъювантной терапии злокачественной глиомы головного мозга у ребенка — Европейские рекомендации»
Оглавление темы «Нейрохирургия опухоли головного мозга.»:
- Схема лучевой терапии опухоли головного мозга — Европейские рекомендации
- Схема химиотерапии опухоли головного мозга — Европейские протоколы
- Схема адъювантного лечения опухоли мозга у ребенка — Европейские рекомендации
- Схема адъювантной терапии злокачественной глиомы головного мозга у ребенка — Европейские рекомендации
- Схема адъювантной терапии медуллобластомы у ребенка — Европейские рекомендации
- Схема адъювантной терапии эпендимомы у ребенка — Европейские рекомендации
- Новые методы лечения опухоли головного мозга и их эффективность
- Алгоритм диагностики аневризмы сосуда головного мозга — Европейские рекомендации
Источник
