Постмастэктомический отек верхней конечности
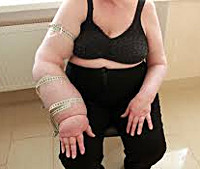
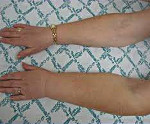
Постмастэктомический синдром — комплекс специфических симптомов, возникающий у пациенток, перенесших радикальную мастэктомию. Проявляется отеком, изменениями кожи, неврологическими и двигательными расстройствами в руке на стороне удаленной груди, депрессией. При постановке диагноза используют результаты физикальных исследований, лимфосцинтиграфии, дуплекс-сонографии, электронейромиографии. Для лечения применяют физиотерапевтические и физические методы (пневматическую компрессию, лимфодренаж и др.), дополненные препаратами с вазоактивным и лимфодренирующим эффектом. В исключительных случаях иссекают измененные ткани, выполняют микрососудистые операции.
Общие сведения
Постмастэктомический отек верхней конечности с комплексом характерных трофических, нейромоторных и психических симптомов — одно из наиболее частых осложнений радикальных операций по поводу злокачественных неоплазий молочной железы. По наблюдениям специалистов, синдром возникает у 16,8-64,6% перенесших мастэктомию. Длительность периода между хирургическим вмешательством и временем появления клинических симптомов в среднем составляет от 10 до 24 месяцев, однако возможна и более поздняя манифестации симптоматики (через 10 и более лет). Статистически чаще расстройство поражает пациенток, у которых удалена правая грудь. Актуальность своевременного выявления патологии обусловлена существенным ухудшением качества жизни и инвалидизацией женщин на поздних стадиях заболевания.

Постмастэктомический синдром
Причины постмастэктомического синдрома
Специфический симптомокомплекс, характерный для больных, перенесших хирургическое вмешательство по поводу рака молочной железы, формируется в раннем послеоперационном и восстановительном периоде на фоне травматических повреждений, реологических и сосудистых нарушений. Выраженность расстройств связана с особенностями репарационных процессов, техникой выполнения и объемом операции, течением послеоперационного периода. Непосредственными причинами постмастэктомического синдрома являются:
- Нарушение сосудистой микроциркуляции. При радикальных методах мастэктомии удаляют подмышечный, подключичный, подлопаточный коллекторы. Это приводит к ухудшению оттока лимфы на стороне поражения. Ситуация усугубляется длительным спазмом сосудов с последующим тромбированием и воспалением (лимфангиитом, тромбофлебитом).
- Рассечение нервных волокон. Во время операции повреждаются многочисленные мелкие нервы, которые обеспечивают иннервацию сосудов и тканей в области шеи, плечевого пояса, руки. Это ухудшает восстановительные постмастэктомические процессы, вызывает болевые ощущения и специфические нарушения чувствительности, получившие название скаленус-синдрома.
- Удаление грудных мышц. Некоторые виды операций при раке молочной железы предполагают резекцию малой и большой грудных мышц на стороне опухоли. Результатом таких вмешательств становится существенное ограничение движений в плече с формированием контрактуры. Патология наблюдается практически у 40% прооперированных.
- Рубцовые изменения тканей. После удаления молочной железы, особенно в случаях, когда оно сопровождается пред- и послеоперационной радиотерапией, в области грудной клетки и подмышечной впадине происходит рубцевание. Выраженность фиброзной деформации увеличивается, если послеоперационный период протекал с гнойно-некротическими осложнениями.
По данным специалистов в сфере маммологии, частота и тяжесть постмастэктомических расстройств зависят от размеров опухоли, степени вовлечения в процесс аксиллярных лимфоузлов, наличия метастазов. Вероятность развития синдрома повышается при распространенности опухолевого процесса, неправильном определении объема операции, нарушении ее техники, неадекватной послеоперационной и лучевой химиотерапии.
Патогенез
Механизм формирования постмастэктомического синдрома основан на изменениях реологических параметров, сосудистой и перисосудистой реакции в пораженной области. Патогенез включает несколько звеньев. В сосудах на пораженной стороне повышается агрегация тромбоцитов, что приводит к спазму и микротромбозам. На фоне нарушенной микроциркуляции развивается перикапиллярный отек. Поскольку амплитуда движений руки на стороне операции ограничена, микронасосная функция скелетных мышц ухудшается. В результате кристаллоиды, белки и вода из межтканевой жидкости медленнее всасываются в микроартериолы, начинают скапливаться в виде отека. Дополнительными факторами патогенеза становятся нейротрофические нарушения и послелучевой фиброз тканей, окружающих магистральные сосуды, что вызывает сужение последних.
Классификация
Единая систематизация форм постмастэктомической патологии пока отсутствует. Большинство предложенных классификаций основано на выраженности отека тканей. При этом авторы учитывают время развития расстройств (ранние, возникшие до 3 месяцев после мастэктомии, и поздние, с отсроченным началом проявлений), плотность тканей (мягкие, твердые, деформированные), изменение объемов. При разнице между обхватом плеча, измеренным над локтем пораженной и здоровой руки, отек до 2 см расценивается как легкий, от 2 до 6 см — средний, свыше 6 см — тяжелый. Российские маммологи и онкологи часто пользуются классификацией постмастэктомического синдрома, основанной на клинических признаках:
- I степень. Отечность локализована в дистальных сегментах пораженной руки (пальцы, кисть), возникает эпизодически. Объем отекшей верхней конечности превышает объем здоровой менее чем на 25%. Снижена температура кожи кисти.
- II степень. В отек вовлечены мягкие ткани предплечья. Кожные покровы трудно захватить в складку. Увеличение объема пораженной руки составляет от 25% до 50%. Отмечается локальное понижение температуры в области кисти и предплечья.
- III степень. Отечность поднимается на плечо и держится постоянно. Ткани плотные, кожа и подкожная клетчатка фиброзно изменены, склерозированы. Кожа не берется в складку. Объем увеличен на 50-70%. Температура кожи снижена в области предплечья и кисти.
- IV степень. Рука деформирована, движения ограничены. Выявляются трофические поражения кожных покровов. Объем пораженной конечности увеличен на 70% и больше. Регистрируется снижение температуры не только на кисти и предплечье, но и на плече.
Существует также комплексная классификация, предложенная отечественными учеными. Она максимально учитывает выраженность отека, время его появления, постоянство, этапность развития, наличие эстетических нарушений, сопутствующей патологии и осложнений, их влияние на привычный образ жизни прооперированной женщины. На основании этих критериев различают следующие стадии постмастэктомического симптомокомплекса:
- Доклиническая стадия. Внешние проявления отечности отсутствуют на протяжении всего дня. Увеличение объема поврежденной верхней конечности не превышает 150,0 мл. Длина окружности плеча не изменена. Субъективных жалоб нет. Цвет кожи нормальный. Кожные покровы хорошо берутся в складку.
- Начальная стадия. Непостоянный отек отдельных сегментов или всей верхней конечности возникает преимущественно к вечеру. Увеличение объема 150-300 мл, окружности плеча — 1-2 см. Пациентка жалуется на тяжесть, периодические боли. Кожа берется в более грубые складки, теряет здоровый цвет.
- Стадия умеренных нарушений. Отечность держится постоянно, не проходит после ночного сна. Пораженная рука увеличивается на 300-500 мл в объеме и на 4-6 см в обхвате плеча. Кожные покровы сложно взять в складку. Они выглядят бледными, появляется синюшный оттенок.
- Стадия выраженных нарушений. Постоянная отечность переходит в плотную фибредему. Объем конечности возрастает на 500-700 мл. Увеличение обхвата плеча — не больше 6 см. Наблюдается деформация тканей с частичной утратой функции конечности. Пациентка испытывает парестезии, боли.
- Отягощенный постмастэктомический отек. Объем верхней конечности увеличивается на 700 мл и больше, окружность плеча — более чем на 6 см. Рука фактически не функционирует, большую часть времени вынужденно подвешена на повязку. Выражены трофические расстройства.
Симптомы постмастэктомического синдрома
Ключевым проявлением симптомокомплекса является постепенно нарастающая отечность мягких тканей, из-за чего эта патология раньше называлась постмастэктомическим отеком (ПМО). Заболевание крайне редко развивается сразу после операции. Обычно первые признаки отечного синдрома клинически определяются спустя несколько месяцев и даже лет после вмешательства. На начальных этапах болезни к вечеру отекают дистальные сегменты верхней конечности (пальцы, кисть), пациентке трудно надеть или снять обручальное кольцо и привычные ювелирные украшения. За ночь отечность полностью проходит. В кисти может возникать ощущение тяжести. По мере развития посмастэктомического синдрома отек поднимается выше — на предплечье, плечо, надплечье, в далеко зашедших случаях он охватывает надключичную область, шею, верхнюю часть грудной клетки.
Сначала кожа над отечными участками сохраняет обычную окраску. Со временем она становится бледной, цианотичной, сухой, шелушащейся. Локальная температура снижается на 0,5-1° С. Постепенно мягкие ткани уплотняются, кожная складка формируется плохо, возможны трофические поражения. Более чем у половины пациенток с постмастэктомическими нарушениями нарушена чувствительность — возникает чувство онемения, ползания мурашек. Интенсивность болевого синдрома варьируется, женщина может ощущать как незначительную тупую, так и продолжительную тупую или кратковременную жгучую боль с иррадиацией в плечо, шею, грудную клетку. Двигательные расстройства представлены ограничением подвижности в плечевом суставе различной степени выраженности. Почти у четверти пациенток диагностируют тяжелую депрессию.
Осложнения
Длительно существующий постмастэктомический синдром может спровоцировать тендовагинит и другие поражения надостной мышцы, хронический бурсит, почти в 40% случаев ограничивающий движения рукой и приводящий к формированию контрактуры. У 1,5-11% пациенток возникают брахиоплекситы и полинейропатические расстройства. Больше чем у 99% прооперированных с такой патологией диагностируется скаленус-синдром. При отеке III-IV степени повышается вероятность рожистого воспаления. В ряде случаев хронический лимфостаз осложняется синдромом Стюарта-Тривса (возникновением лимфангиосаркомы). Поскольку посмастэктомические нарушения негативно сказываются на профессиональной пригодности женщины, их развитие сопровождается снижением самооценки, нарастанием невротической симптоматики и депрессивного синдрома.
Диагностика
При диагностике постмастэктомических нарушений в первую очередь учитывают данные физикальных исследований — оценивают объем здоровой и пораженной конечностей, их обхват над локтевым суставом, определяют кожную температуру для выявления степени ее снижения, проверяют чувствительность кожи и амплитуду движений в плече. Инструментальные методы исследования позволяют верифицировать уровень повреждения сосудистого русла, оценить функциональную состоятельность тканей. Чаще всего назначают следующие исследования:
- Лимфосцинтиграфия верхних конечностей. Радиоизотопный метод, пришедший на смену традиционной лимфографии, визуализирует особенности строения лимфатической системы, выявляет участки застоя лимфы и объективизирует снижение скорости лимфотока.
- Дуплексное сканирование. Сочетанное проведение ультразвукового и допплерографического исследования направлено на определение скорости кровотока, анатомических особенностей и проходимости артериальных и венозных сосудов.
- Электронейромиография. Методика позволяет объективно оценить функциональное состояние периферических нервов, иннервирующих кожу, мышцы и сосуды верхних конечностей, диагностировать выраженность неврологических расстройств.
В ходе комплексного обследования выполняют лабораторные анализы для оценки системы гемостаза, в сложных клинических случаях проводят МРТ, КТ. Дифференциальная диагностика заболевания, как правило, не представляет особых сложностей с учетом возникновения нарушений после мастэктомии. Несмотря на очевидность причин развития постмастэктомического синдрома, необходимо сохранять настороженность в отношении других причин лимфостаза — доброкачественных и злокачественных опухолей лимфатической системы, воспалительных сосудистых заболеваний. При необходимости к обследованию пациентки привлекают хирурга, онколога, лимфолога, флеболога, невропатолога, дерматолога, инфекциониста.
Лечение постмастэктомического синдрома
Врачебная тактика при развитии отека, неврологических и двигательных расстройств после мастэктомии направлена на восстановление нарушенных функций — облегчение лимфодренажа, разработку плечевого сустава, нейростимуляцию. Ведущей является комплексная консервативная терапия, которая лишь в крайних случаях дополняется хирургическими методиками. Пациенткам с постмастэктомической болезнью назначают:
- Физические и физиотерапевтические воздействия. Наиболее эффективны аппаратная пневматическая компрессия руки от пальцев и кисти до надплечья, ручной и механический лимфодренаж. Эти методики дополняют специальными физическими упражнениями, ношением бандажей, многослойных неэластичных и эластических повязок. Предварительное применение ультразвука позволяет «размягчить» ткани, уменьшить остеомиофасциальные боли, улучшить чувствительность и подвижность в суставах. Некоторые специалисты получили хорошие терапевтические результаты при использовании световой и низкоуровневой лазеротерапии, электромиостимуляции.
- Медикаментозное лечение. Из фармакологических средств при послемастэктомическом синдроме часто назначают бензопироны — препараты с вазоактивным, антиэдематозным и противовоспалительным эффектом. Для усиления их действия применяют ангиопротекторы, капилляростабилизаторы, антиагреганты, витамины с антиоксидантным действием. Хороший эффект в купировании болевого синдрома и коррекции нейродвигательной патологии достигается при введении психоаналептиков и протеолитических ферментов. При выраженной боли и эмоциональных расстройствах допустимо использование седативных и нестероидных противовоспалительных средств.
- Хирургические методы. Оперативный подход к устранению постмастэктомического лимфостаза практикуется редко. В ходе хирургической коррекции иссекается рубцовая ткань с замещением дефекта собственной кожей или кожно-мышечным лоскутом пациентки. Микрососудистые техники позволяют сформировать лимфовенозные анастомозы, освободить от сращений подключичную и подмышечную вены. Возможности хирургического лечения у больных с нарушениями после мастэктомии ограничены многостадийностью, травматичностью, сложностью технического исполнения, достижения стойких функциональных и косметических результатов.
Прогноз и профилактика
Несмотря на высокую терапевтическую резистентность расстройства, комплексный подход и своевременное начало лечения на ранних стадиях постмастэктомического синдрома позволяют уменьшить выраженность отека и улучшить функциональные возможности пораженной руки. С профилактической целью необходимо обоснованно определять вид и объем вмешательства при злокачественном новообразовании груди, тщательно соблюдать технику выполнения операции. В конце первой недели послеоперационного периода показаны дозированные упражнения для разработки плечевого сустава, с 3 недели — самомассаж мышц и кожи. В последующем женщине рекомендуются умеренные физические нагрузки, исключение сдавливаний руки, ее защита от возможной травматизации на производстве или в быту.
Источник
… является составной частью, так называемого постмастэктомического синдрома.
Постмастэктомический отек верхней конечности (ПМО) – это отек, возникающий после всех радикальных операций на молочной железе, которые проводятся с (!) обязательной подмышечной лимфодиссекцией, при которой неизбежно пересекаются коллекторные лимфатические сосуды, осуществляющие лимфатический отток от верхней конечности.
По различным статистическим данным, независимо от выбранных методов лечения, ПМО развивается у 10-80% больных раком молочной железы после курса терапии.
Причинами развития ПМО являются следующие этиопатогенетические факторы: (1) нарушения сосудистой микроциркуляции, вследствие удаления подключичного, подмышечного и подлопаточного лимфатических коллекторов, а также вследствие расстройства иннервации сосудов руки в результате травмирования (пересечения) многочисленных мелких нервов при мастэктомии и вследствие длительного спазмв сосудов с последующим тромбозом, тромбофлебитом и лимфангиитом; (2) гнойно-некротические осложнения в зоне операционной раны, а также рожистое воспаление верхней конечности на стороне поражения; (3) также возможной причиной развития ПМО по является пролонгированный курс телегамматерапии.
Предикторы развития ПМО: (1) большой размер опухоли; (2) клинические проявления поражения подмышечных лимфатических узлов; (3) наличие метастазов; (4) хирургическая операция, в том числе, выполненная в недостаточном объеме; (5) недостаточность или отсутствие послеоперационной химиотерапии; (6) послеоперационная лучевая терапия; (7) рецидив заболевания.
Дополнительным фактором, способствующим развитию ПМО и увеличению его частоты является индивидуальный вариант лимфотока верхней конечности в виде отсутствия анатомических компенсаторных механизмов, которые позволяют сохранять достаточный лимфатический дренаж от конечности после пересечения коллекторных лимфатических сосудов.
Клиническими проявлениями ПМО могут быть (в различных комбинациях): припухлость, онемение, парестезии, болевой синдром разной степени выраженности (от незначительной болезненности до внезапной жгучей или продолжительной тупой боли с разнообразной иррадиацией); чувство тяжести; судороги и спазмы; потеря или существенное ограничение подвижности; повышение местной температуры; сухость кожи. Данная симптоматика может появляется, как непосредственно или в ближайшее время после мастэктомии, а также и в более отдаленные сроки: средние сроки появления ПМО, указанные в работе А.Р. Pecking (1995), составили 17 ± 7,6 месяца. . Среди психиатрической патологии у пациенток с ПМО наиболее часто встречаются беспокойство, тревога, психическое истощение, тяжелая депрессия.
Осложнения ПМО: повреждения m. supraspinatus, хронический бурсит, контрактура или ограничение амплитуды движений плечевого сустава, плекситы и невропатии, целлюлит, скаленус-синдром, развитие в ряде наблюдений лимфангиосаркомы на фоне длительно существующего лимфостаза верхней конечности – синдром Стюарта-Тривса. Наличие ПМО обычно негативно воздействует на профессиональные навыки женщин (иногда приводя к потере трудоспособности), значительно осложняя межличностные и семейные отношения у пациенток с раком молочной железы, (!) вследствие чего у них происходит снижение самооценки, а также самоуважения.
Классификация. Единая классификация ПМО отсутствует. Классификации, основанной на учете времени возникновения ПМО ( В.А. Удяка (1972): (1) ранний ПМО — развивается до 3 месяцев после проведенного радикального лечения; (2) поздний ПМО- развивается через 3 месяца после проведенного радикального лечения. А.О. Левин и соавт. (1987) выделяют следующие формы (рассматривая их как этапы) ПМО (1) преходящую,(2) мягкую, (2) плотную и (3) деформирующую. Д.Н. Ефремов (1963) подразделяеь ПМО на три степени: (І) резко выраженный лимфостаз, когда окружность плеча превышает 6 см (по сравнению со здоровой конечностью); (ІІ) умеренно выраженный лимфостаз с разницей в окружности плеча от 3 до 6 см; (ІІІ) незначительный лимфостаз с разницей длины окружности плеча от 1,5 до 3 см.
Классификация ПМО (наиболее значимая), предложенная Т.А. Пантюшенко,М. Бельтраном (1990):
• І степень (стадия доклинических проявлений ПМО): объем руки на стороне поражения увеличивается до 150 мл по сравнению с противоположной верхней конечностью; заметных изменений в длине окружности плеча выявить не удается.
• ІІ степень (начало клинических проявлений ПМО): объем руки превышает противоположную конечность на 150-300 мл, длина окружности плеча – на 1-2 см; при этом зрительно отмечается непостоянный отек всей руки или отдельных ее сегментов; едема появляется к вечеру и исчезает к утру; больные ощущают тяжесть в руке, иногда испытывают болевые ощущения; кожа постепенно утрачивает цвет, присущий здоровой конечности, берется в более грубые складки.
• ІІІ степень (умеренно выраженный ПМО): увеличение объема руки на 300-500 мл или окружности длины плеча на 2-4 см; отек руки приобретает постоянны й характер, самостоятельно к утру не исчезает; кожа становится синюшной, бледной, с трудом берется в складку.
• ІV степень (выраженный ПМО): превышение объема руки на 500-700 мл или длины окружности плеча на 4-6 см; наступает постоянный отек руки с переходом в фибредему. Конечность деформируется, частично утрачивает свою функцию.
• V степень (отягощенный ПМО): увеличение объема руки на 700 мл и более или окружности плеча свыше 6 см; конечность полностью утрачивает свою функцию; появляются выраженные трофические нарушения. Больные вынуждены держать руку в подвешенном состоянии.
Диагностика ПМО начинается с клинического обследования больных в виде определения степени увеличения объема конечности, а также степени напряжения и гидрофильности мягких тканей конечности («доклиническая», «преходящего», «мягкого», «плотного» и «деформирующего» отека стадии), наличия или отсутствия стеноза подключичной вены и венозной гипертензии. Клиническое обследование дополняется специальными методами исследования, важнейшими из которых являются: (1) динамическая лимфосцинтиграфия (позволяющая получить прижизненное контрастирование функционально полноценных лимфатических сосудов и узлов), (2) флеботонометрия (измерение интравенозного давления в поверхностных венах конечности), а также (3) флебография, (4) ультразвуковое исследование мягких тканей конечности и в ряде случаев (5) компьютерная томография.
Лечение. Все методы лечения пациенток с ПМО можно разбить на 3 группы: физические и физиотерапевтические; медикаментозные; хирургические. Наиболее эффективным из физических и физиотерапевтических методов лечения ПМО в настоящее время являются: (1) пневматическая компрессия с последовательным сдавлением верхней конечности от дистальных отделов к проксимальным, (2) механический лимфатический и ручной лимфатический дренаж. Медикаментозная терапия является обязательной составной частью консервативной терапии ПМО и включает несколько групп препаратов. Основными из них являются лекарственные средства, стимулирующие лимфодренажную функцию конечности и воздействующие одновременно на венозный тонус, улучшая лимфатический отток (например, диосмин). Кроме того, по показаниям используют антибиотики, десенсибилизирующие препараты, иммуномодуляторы.
Хирургические методы лечения ПМО. Хирурги проводят удаление фиброзно-измененных тканей с последующей аутодермопластикой, пластикой кожномышечным лоскутом, формированием лимфовенозных анастомозов, флеболизом подмышечной и подключичной вен, липосакцией, комбинацией липосакции и трансплантации кожномышечного лоскута m. latissimus dorsi. Поскольку подобные методы лечения многостадийны, травматичны, требуют разработки особой микрохирургической техники и не всегда дают положительные косметические и функциональные результаты, предпочтение все же следует отдавать консервативным методам.
Профилактические мероприятия. В.И. Дрижак и соавт. (1998) к мерам профилактики ПМО относят применение поперечного разреза кожи, тщательную сепаровку ее лоскутов, предпочтительность интенсивного облучения перед пролонгированным курсом лучевой терапии. Они рекомендуют пациенткам при отсутствии осложнений начиная с 6-7-х суток после операции выполнять дозированные активные упражнения для плечевого и локтевого суставов, постепенно увеличивая нагрузки. Через 2 недели в комплекс упражнений включают массаж пояса верхней конечности – различные виды поглаживания и растирания, позднее – разминание мышц в разных направлениях. Контроль эффективности восстановительного лечения осуществляли путем определения окружности плеча, силы мышц кисти и предплечья (динамометрия), амплитуды движений в плечевом суставе в динамике.
V.S. Erickson et al. (2001) выделяют четыре основных категории профилактических мероприятий: (1) уклонение от избыточной интраоперационной травматизации; (2) предупреждение инфицирования; (3) недопущение любого сдавливания руки; (4) функциональную нагрузку и лечебную физкультуру. Сюда включены следующие меры предосторожности: перчатки при работе дома или в саду/на даче; избегать венепункций, инъекций и измерений давления на «отекоопасной» верхней конечности; оказывать первую помощь при любых повреждениях руки, даже самых незначительных; избегать источников тепла и длительной «экспозиции» на солнце; избегать любой тесной одежды для «отекоопасной» верхней конечности; придерживаться умеренной функциональной активности верхней конечности; не носить тяжести; избегать резких движений.
Источник
