Каррагениновый отек что это такое

Физико-химические характериситики
INCI Name: Stearyl Glycyrrhetinate
- Внешний вид: белый слегка желтоватый кристаллический порошок с характерным слабовыраженным запахом, практически безвкусный.
- Химическая формула: С48Н82О4
- Молекулярная масса: 723.18
- Растворим: в этиловом спирте, стеариловом спирте, растительных маслах (оливковом, кунжутном, хлопковом), сквалане, вазелиновом масле, жидком парафине.
- Не растворим: в воде, глицерине и пропиленгликоле.
- Точка плавления: 70–77°С
- Стабильность: Обладает очень высокой стабильностью к нагреванию, свету, влажности и другим имеющим значение факторам.
Свойства
Стеарил глицирретинат получают реакцией этерификации глицирретиновой кислоты, обладающей выраженным противовоспалительным действием, и стеарилового спирта. В отличие от глицирретиновой кислоты, которая практически не растворяется в маслах и жирах, используемых для создания косметических рецептур, стеарил глицирретинат прекрасно растворим в маслах.
Стеарил глицирретинат — продукт, обладающий мощным противовоспалительным действием, не токсичный, хорошо растворимый в маслах или жирах по сравнению с глицирретиновой кислотой. Противовоспалительная активность стеарил глицирретината в два и больше раза выше, чем глицирретиновой кислоты, что было доказано в тестах на животных с использованием эквимолярных концентраций того и другого вещества.
В настоящее время, предлагаемое производное глицирретиновой кислоты широко используется в производстве косметики и лекарственных средств для предотвращения и лечения воспаления и раздражения кожи.
Следует особенно отметить чрезвычайную стабильность стеарил глицирретината к нагреванию, свету, влажности и другим имеющим значение факторам. Тест на старение (более чем три года) ни с чем не смешанного продукта показал, что не произошло почти никаких изменений удельных величин, характеристических величин, внешнего вида и т.д. Образцы мазевой основы, содержащей 0.5% стеарил глицирретината, хранили при комнатной температуре и одновременно при 40°С на протяжении 2 лет и 6 месяцев. Не наблюдалось никаких изменений в обоих образцах.
Безопасность (химическая активность, мутагенность)
Имеющиеся данные не подтверждают физической или химической опасности.
Не реактивно. Продукты опасного разложения отсутствуют.
Мутагенность стеарил глицирретината проверяли методом «Ames test» (тест на канцерогенность по частоте мутаций), используя штаммы Salmonella typhymurium и Escherichia coli, и по результатам тестирования сделали вывод, что стеарил глицирретинат не оказывает мутагенного действия. Острую токсичность проверяли на мышах интраперитонеальным введением, подострую токсичность тестировали на крысах пероральным введением и на кроликах по раздражающему действию на слизистую оболочку глаз, а также на людях посредством раздражающего теста на коже.
Фармакология и действие. Противовоспалительная активность
Метод каррагенинового отека
В тесте проверяли противовоспалительную активность 3-стеароилокси глицирретината, стеарил глицирретината (Производства Maurzen Pharmaceuticals Co., Ltd) и индометацина, как положительного контроля. Мази (W/O эмульсионная основа и O/W эмульсионная основа), содержащие 0.5% или 1.0% тестируемых веществ, наносили на кожу самцов крыс линии Wistar с массой тела приблизительно 130±10г. Раствор каррагенина использовали как индуктор воспаления.
кспериментальная процедура заключалась в следующем: за 1–2 часа до введения каррагенина, 50 мг мази наносили на стопу правой задней лапки крыс, втирая. Далее 0.1 мл 1% раствора каррагенина вводили подкожно в стопу правой задней лапки крыс. Впоследствии через определенные промежутки времени определяли размер отека объемным методом.
Результаты
В W/O эмульсионной основе, коэффициент ингибирования стеарил глицирретината практически равен (немного меньше) коэффициенту ингибирования индометацина, положительного контроля. Что касается 3-стеароилокси глицирретината, то его ингибирующая способность приблизительно в 2 раза ниже, чем у стеарил глицирретината.
В O/W эмульсионной основе заметное ингибирование наблюдалось только в случае 1% стеарил глицирретиновой мази через 3 часа после введения каррагенина.
Даже индометацин, как положительный контроль, ингибировал явно слабее по сравнению с W/O эмульсионной основой.
Полученные результаты показывают необходимость тщательного изучения эмульсионных основ, использованных в эксперименте, т.к. эффективность исследуемых лекарственных средств очень сильно зависела от вида основы-носителя.
И стеарил глицирретинат, и 3-стеароилокси глицирретинат, как и предполагалось, — высоко эффективные противовоспалительные средства для наружного применения в действующих концентрациях.
Влияние на контактный дерматит, вызванный пикрилхлоридом
Методика тестирования
В эксперименте исследовались следующие образцы:
- Раствор этилового спирта (контроль)
- Раствор этилового спирта, содержащего 0.1% стеарил глицирретината
- Раствор этилового спирта, содержащий 0.4% глицирризиновой кислоты
Подопытным животным (мышам) за 1 день до сенсибилизации сбривали шерсть с брюшной области таким образом, чтобы не повредить кожу (площадь: приблизительно 25 х 20 мм). Затем на обезволошенный участок кожи наносили сенсибилизатор — 4% раствор пикрилхлорида в этиловом спирте (100 мкл) по каплям и распределяли равномерно. Шесть дней спустя, измеряли толщину ушных раковин и затем наносили по 20 мкл стимулирующего антигена (1% раствор пикрилхлорида в оливковом масле) на переднюю и заднюю поверхности обеих ушных раковин (первая стимуляция). Через 24 часа снова измеряли толщину ушных раковин. Уровень отека рассчитывали, вычитая из полученной величины толщину до стимуляции.
Отобрав мышей в достаточной мере сенсибилизированных после первой стимуляции, на переднюю и заднюю поверхность правого уха наносили 20 мкл исследуемого образца в течение недели. И еще раз капельно наносили сенсибилизатор (100 мкл) на побритый участок и равномерно распределяли.
После сенсибилизации 20 мкл тестируемого образца наносили на переднюю и заднюю поверхности правой ушной раковины на протяжении недели и измеряли толщину Толщиномером. 20мкл стимулирующего антигена наносили на переднюю и заднюю поверхности правой ушной раковины и измеряли толщину через 24 часа. Уровень отека рассчитывали, вычитая из полученной величины толщину до стимуляции.
Результаты
Полученные данные демонстрируют, что раствор этилового спирта, содержащий 0.1% стеарил глицирретината ингибировал развитие отека приблизительно на 33% по сравнению с контролем. В свою очередь раствор этилового спирта, содержащий 0.4% глицирризиновой кислоты, ингибировал развитие отека всего лишь на 14%.
Исходя из вышесказанного, можно сделать вывод, что стеарил глицирретинат может удовлетворительно подавлять развитие аллергических реакций IV типа.
Потенцирование противовоспалительной активности стеарил глицирретината.
Тестируемые субстанции
- Стеарил глицирретинат (М-2, S-2)
- αБисаболол ((-)-α-Bisabolol nat.: BASF) (M-3, S-3)
- Индометацин (SIGMA)(M-4, S-4)
В качестве образцов использовали липосом-эмульгированный крем (NikkoChemicals Co., Ltd) и базы (М-1, S-1), содержащие выше перечисленные тестируемые субстанции в концентрации 0,1%.
Базы
| Tri-2-ehtylhexaglyceryl (NIKKOL Trifat S-308) | 8.0 |
| 1,3-Butylene glycol | 7.0 |
| Glyceryl monostearate (NIKKOL MGS-DEX) | 4.5 |
| Squalane (NIKKOL Squalane) | 4.0 |
| Cetanol (Nikkol Cetanol) | 4.0 |
| POE (40) monostearate (NIKKOL MYS-40) | 1.5 |
| Antiseptic mixture (Sasept, Seiwa kasei) | 0.2 |
| Purified water | более 100 |
| Tri-2-ehtylhexaglyceryl (NIKKOL Trifat S-308) | 8.0 |
| 1,3-Butylene glycol | 7.0 |
| Squalane (NIKKOL Squalane) | 4.0 |
| Squalane (NIKKOL Squalane) | 2.0 |
| Carboxyvinylpolimer (Carbopol 940:BF Goodrich) | 0.3 |
| Carboxyvinylpolimer (Carbopol 940:BF Goodrich) | 0.3 |
| Antiseptic mixture (Sasept, Seiwa kasei) | 0.2 |
| Purified water | более 100 |
Методика тестирования
Эксперимент проводили согласно стандартной методике каррагенинового отека
1. Состав групп и количество животных в группе:
| 1 | Ничем необрабатываемая группа | 6 |
| 2 | Контроль (Кремовая база) М-1 | 6 |
| 3 | 0.1% стеарил глицирретината М-2 | 6 |
| 4 | 0.1% α-Бисаболола в креме М-3 | 6 |
| 5 | 0.1% индометацина в креме М-4 | 6 |
| 1 | Ничем необрабатываемая группа | 6 |
| 2 | Контроль (Кремовая база) S-1 | 6 |
| 3 | 0.1% стеарил глицирретината S-2 | 6 |
| 4 | 0.1% α-Бисаболола в креме S-3 | 6 |
| 5 | 0.1% индометацина в креме S-4 | 6 |
2) Приготовление образцов: липосом-эмульгированный крем, содержащий Стеарил глицирретинат (CO-grhetinol), α-Бисаболол и Индометацин в концентрации 0.1% соответственно, производства Nikko Chemicals Co., Ltd.
3) Измерительное оборудование: измеритель объема (Model TK-105, Muromachi Kikai Co., Ltd.) для крыс и мышей.
4) Методика: после того как животные были поделены на группы, их нумеровали и измеряли вес тела. Кроме того, измеряли объем правой задней ступни. За один и два часа до введения воспалительного агента, 50 мг крема тщательно втирали в правую заднюю ступню. Обработанную ступню осторожно покрывали оберточной бумагой.
Воспалительный агент, 1% каррагенина в соляном растворе, (0.1 мл на крысу) вводили подкожно в правую ступню.
Объем правой ступни измеряли через 1, 2, 3 и 4 часа после введения каррагенина.
5) Критерии оценки: cтепень отека рассчитывали, сравнивая измеренные объемы ступни до и после введения каррагенина. Коэффициент ингибирования вычисляли через 3 и 4 часа после каррагениновой инъекции и сравнивали с результатами, полученными в контрольной группе.
6) Оценивали статистическое значение расхождений в степени ингибирования через 3 и 4 часа в исследуемых группах и контроле.
Результаты
Из полученных данных следует, что в случае использования М-типа крема, как базы-носителя, даже индометацин, положительный контроль, ингибировал развитие каррагенинового отека всего лишь на 20%. Подавляющее действие стеарил глицирретината было еще меньше и практически не отличалось от контроля. Собственно сама кремовая база М-типа индуцировала развитие отека на 10–15%.
Если же S-типа крем применялся в качестве базы-носителя, стеарил глицирретинат показывал высокую супрессивную активность — от 30 до 40 %, что даже выше, чем у индометацина (приблизительно 25%). Сама кремовая база S-типа индуцировала развитие отека менее чем на 10%.
Бисаболол не проявил никакой ингибирующей активности ни в одной кремовой базе.
Обсуждение
Результаты эксперимента подтвердили, что O/W крем на основе лецитина обеспечивает проникновение стеарил глицирретината в кожу. В составе такой базы стеарил глицирретинат демонстрирует противовоспалительную активность даже выше, чем у индометацина. Раздражающее действие самого лецитинового крема — слабое и поэтому он идеально подходит как база-носитель для эксперимента. При использовании базы-носителя, приготовленной на основе неионогенного ПАВ, тестируемые вещества были значительно менее эффективными. Бисаболол в тестируемой концентрации был не эффективен.
Подводя итог, можно сказать, что O/W крем на основе лецитина — прекрасная база, чтобы обеспечить достаточную фармакологическую активность небольшого количества стеарил глицирретината.
Заключение
Фармакологическое преимущество O/W крема, приготовленного на основе лецитина.
Для того чтобы обеспечить терапевтический эффект препаратов местного назначения, базовая рецептура должна обладать рядом характеристик, например, способностью удерживать влагу, сродством к коже, совместимостью с активными ингредиентами, хорошими смазывающими свойствами, мелким размером частиц самой эмульсии. Практически все базовые рецептуры имеют свои преимущества и недостатки.
В проведенном эксперименте O/W крем, приготовленного на основе лецитина показал себя необыкновенно эффективным, как база-носитель, обладающая всеми вышеперечисленными свойствами. Кроме того, преимущество лецитина заключается еще и в том, что он является важным компонентом биомембран, обеспечивает доставку активных веществ в кожу, обладает низкой раздражающей способностью.
Клинические исследования
Клинические исследования по изучению действия Cтеарил Глицирретината на повреждение кожи, вызванное В-ультрафиолетовыми лучами.
Поскольку предполагалось, что противовоспалительное действие стеарил глицирретината может предотвратить пост-воспалительную пигментацию, то в данном эксперименте оценивали эффективность стеарил глицирретината против эритемы, вызванной ультрафиолетовым облучением.
Методика тестирования
Группа, в которой проводилось исследование, состояла из 10 взрослых мужчин в возрасте от 26 до 47 лет. У всех участников эксперимента отсутствовали какие-либо симптомы экземы или воспаления кожи. В конце эксперимента кожные покровы 10 мужчин проверяли и оценивали результат.
Согласие пациентов: перед началом исследования было получено письменное согласие участников, которым подробно объяснили следующее:
- Объекты и методики изучения;
- Предполагаемый результат и возможные побочные эффекты;
- Право всех субъектов свободно принимать решение об участии в эксперименте;
- Право всех субъектов отозвать свое согласие об участии в эксперименте в любое время;
- Свободу всех субъектов от каких-либо взысканий или неприятных последствий в случае отказа от участия в эксперименте или в случае отзыва согласия;
- Гарантию защиты прав субъектов, включая медицинскую ответственность за возникновение побочных эффектов.
Рецептура образца для тестирования
Образец крема для данного исследования был изготовлен Nihon Surfactant Kogyo Co., Ltd.
| Batyl alcohol, steatic acid, caprylic/capric triglyceride and lecithin | 3.5 | 3.5 | 3.5 |
| Cethanol | 2.0 | 2.0 | 2.0 |
| Olive squalane | 20.0 | 20.0 | 20.0 |
| Trioctanoin | 6.0 | 6.0 | 6.0 |
| Propyparaben | 0.1 | 0.1 | 0.1 |
| Methyparaben | 0.2 | 0.2 | 0.2 |
| Glycerin | 3.0 | 3.0 | 3.0 |
| Xanthan gum | 15.0 | 15.0 | 15.0 |
| Stearyl Glycyrrhetinate | — | 0.1 | — |
| α-Bisabolol | — | — | 0.3 |
| Purified water | to 100 | to 100 | to 100 |
Определение интенсивности ультрафиолетового излучения
Для тестирования средняя часть левого плеча была условно поделена на три секции. В целом, считалось, что в обычной жизни эта часть руки мало подвержена воздействию света.
Чтобы подобрать дозу облучения достаточную для возникновения эритемы, определяли индивидуальную чувствительность кожи участников эксперимента к ультрафиолету. В качестве источника ультрафиолета применяли лампу UVB:TRANSILLUMINETOR UV-302 (λmax: 310 нм). Интенсивность облучения измеряли с помощью цифрового измерителя интенсивности ультрафиолетового излучения (UVX-31:310 nm, Ultra-Violet Products, Ltd). Для эксперимента применяли интенсивность 800 μW/cm?.
Методика и время нанесения
Приблизительно 10–15 г тестируемой субстанции наносили на поверхность кожи, выбранную для облучения, дважды в день, утром (около 9.00) и вечером (около 17.00). Таким образом поступали пять раз в неделю на протяжении двух недель до начала эксперимента, т.е. до облучения. Кожу перед облучением тщательно очищали теплой водой.
Результаты наблюдений за кожей записывали до начала эксперимента и через один, два и три дня после облучения ультрафиолетом.
Наблюдение за кожей
До эксперимента
Учитывалась любая гиперчувствительность к применяемым препаратам или свету, а также наличие и степень повреждения кожи.Измерения в процессе эксперимента
Отмечали наличие и степень повреждения участков кожи, на которые наносили тестируемые вещества. Выраженность эритемы оценивали с помощью колориметра в соответствии со стандартным значением а*.
С момента начала эксперимента исследуемые области фотографировали каждые раз, когда оценивали состояние кожи. Степень улучшения состояния кожи оценивали с помощью колориметра на дату каждого планового наблюдения.
Результаты
Коэффициент предотвращения UVB-индуцированной эритемы.
| A | Плацебо | 5.93 ± 0.93 | — |
| B | Бисаболол | 6.49 ± 1.16 (р=0.0937) | -21.94 ± 30.51 |
| C | СГ | 6.49 ± 1.16 (р=0.0937) | -21.94 ± 30.51 |

Выводы
Использование 0.1% Стеарил глицирретината на протяжении двух недель до UVB-облучения предотвращало развитие эритемы.
0.1% стеарил глицирретината подавляет образование эритемы более чем на 33% по сравнению с плацебо, в то время как 0.3% бисаболола в составе крема способствовало развитию воспаления.
Проведенный эксперимент подтверждает эффективность стеарил глицирретината как профилактического ингредиента воспаления.
Тесты на безопасность
Кожная аллергическая проба (пач-тест)
Тестируемые рецептуры
Shoichi Asahi and Koichi Kitamura, Department of Dermatology, Kyusyu University, School of Medicine
- А: Эмульсия на основе вазелина, содержащая 2% стеарил глицирретината
- В: Эмульсия на основе вазелина, содержащая 2% стеарил глицирретината
- С: Эмульсия на основе вазелина (контроль)
В качестве субъектов для данного исследования были выбраны 18 здоровых человек и 14 пациентов с кожными заболеваниями (4 с острой экземой, 5 с хронической экземой и 5 с дерматитом, появившемся в результате медикаментозного лечения трихофити). Ни у одного из выбранных участников эксперимента не было заболеваний кожи предплечья.
Методики
Тестируемые рецептуры равномерно распределяли на куске марли и наносили на кожу сгибательной поверхности предплечья. Через 24 часа наблюдали воспалительную реакцию.
Метод оценки — cтепень воспалительной реакции оценивали согласно следующим критериям
- Отсутствие эритемы — отрицательная реакция (–)
- Наличие эритемы — положительная реакция (+)
Результаты
Пач-тест у здоровых людей: Эритема не наблюдалась ни на одной кожной поверхности, обработанной тестируемыми рецептурами. Т.е. все рецептуры показали отрицательную реакцию у всех субъектов исследования.
Пач-тест у пациентов с заболеваниями кожи: Эритема не наблюдалась ни на одной кожной поверхности, обработанной тестируемыми рецептурами. Т.е. все рецептуры показали отрицательную реакцию у всех субъектов исследования.
Выводы
Кожные аллергические пробы эмульсии на основе вазелина, содержащей 2% стеарил глицирретината, и эмульсии на основе вазелина, содержащей 2% стеароил глицирретината, проводились среди 32 субъектов (18 здоровых человек и 14 пациентов с заболеваниями кожи); эмульсию на основе вазелина использовали как контроль. Все исследуемые рецептуры показали отрицательную реакцию у всех субъектов эксперимента, т.е. ни одна рецептура не вызвала раздражения кожи.
Острая токсичность
- Острая токсичность (на мышах)
LD50 > 6000 мг/кг - Острая токсичность (на крысах)
LD50 > 4000 мг/кг
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Русских И.С.
1
Черемных А.И.
1
1 ФГБОУ ВО Пермский государственный медицинский университет им. Акад. Е.А.Вагнера Минздрава России
Впервые в 1958 г. Арон Лернер из Йельского университета (США) выделил из эпифиза быка, изучил и описал структуру мелатонина (N-ацетил-5-метокситриптамин). Эта биологически важная молекула впоследствии была найдена в сетчатке глаза, клетках костного мозга, кишечника и кожи. Существует ряд клинических и экспериментальных данных о влиянии мелатонина на различные патологические состояния, связанные с воспалением. Среди них воспалительные поражения суставов, внутренних органов (например, язвенный колит), периферических нервов. Следует сразу подчеркнуть, что такие факты не всегда однозначно указывают на клиническую эффективность препарата. Целью нашего исследования стало определение противовоспалительной активности мелатонина на модели «каррагенинового» отека лапы у крыс. Острую воспалительную реакцию (отек) воспроизводили субплантарным (под подошвенный или плантарный апоневроз) введением 0,1 мл 1% раствора каррагенина (сульфатированный полисахарид из ирландского морского мха). Выраженность воспалительной реакции оценивали через 3, 12 часов после индукции воспаления по изменению объема лапы (онкометрически). Исследуемые вещества наносили на лапы крыс в виде мази. Противовоспалительный эффект, оцениваемый по уменьшению отека, выражали в процентах по отношению к контролю. По результатам исследования на основании данных онкометрических измерений при индукции «каррагенинового» отека лап у крыс показано, что мелатонин обладает выраженным противовоспалительным действием.
мелатонин
воспаление
клиническое исследование
каррагениновый отек
противовоспалительный эффект
1. Верин, В. К. Гормоны и их эффекты / В.К. Верин, В.В. Иванов. — М.: Фолиант, 2011. — 136 c.
2. Миронов, А.Н. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. – М.: Гриф и К, 2012. – 944 с.
3. Melatonin: a hormone, a tissue factor, an autocoid, a paracoid, and an antioxidant vitamin / D. X. Tan// J. Pineal. Res. – 2003. – Vol. 34,ol. №1. – P.75-78.
4. Melatonin cytotoxicity in human leukemia cells: relation with its pro-oxidant effect / M. Buyukavei// Fundam. Clin. Pharmacol. – 2006. – Vol. 20, №1. – P. 73-79.
5. Zimecki, M. The lunar cycle: effects on human and animal behavior and physiology / M. Zimecki// Postepy Hig. Med. Dosw. (Online). – 2006. — № 60. – P.1-7.
Впервые в 1958 г. Арон Лернер из Йельского университета (США) выделил из эпифиза быка, изучил и описал структуру мелатонина (N-ацетил-5-метокситриптамин) (рис.1). Эта биологически важная молекула впоследствии была найдена в сетчатке глаза, клетках костного мозга, кишечника и кожи. Изначально мелатонин считался гормоном, участвующим в синхронизации механизмов циркадного ритма в организме.
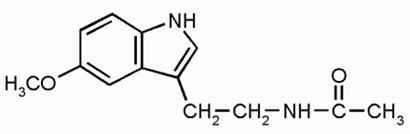
Рис.1 Структурная формула мелатонина
Позже было установлено, что кроме этой гормональной функции он принимает участие в регуляции сезонного и лунного циклов у животных и человека. Кроме того, он является тканевым фактором и одним из самых мощных и доступных эндогенных антиоксидантов и регуляторов иммунной системы. Если учесть, что мелатонин синтезируется также лимфоцитами, а рецепторы мелатонина найдены в мембранах тимоцитов, это дополнительно свидетельствует о значительном влиянии на функцию иммунной системы [5].
В организме человека мелатонин принимает участие в формировании многих патологических событий, включая канцерогенез и старение, когда отмечается снижение уровня данного гормона. Кроме того, уровень мелатонина в крови снижен у хронических курильщиков и у людей с повышенным индексом массы тела.
Свойства мелатонина:
· снижается температура тела;
· уменьшается уровень стрессовых гормонов и эмоциональное напряжение;
· возникает сонливость, наступает сон;
· падает давление крови, замедляется ритм сердечных сокращений;
· расслабляются мышцы;
· тормозится работа органов пищеварения и половой системы;
· восстанавливаются обменные процессы в головном мозге, происходит обработка информации, полученной за день.
Концентрация гормона достигает максимума к полуночи, держится на высоком уровне до 5 часов утра. Максимальные показатели гормона в детском возрасте, затем в период полового созревания они снижаются и вновь возрастают у молодых людей 20-23 лет. После 50 лет начинается прогрессивное уменьшение синтеза гормона и к 65 годам его в крови содержится на 20% меньше, чем у 45-летних [1].
Локальная мелатонинергическая система обнаружена в коже животных и человека. Мелатонин кожи участвует в процессах роста и пигментации волос, защищает клетки от воздействия ультрафиолета и других экзогенных и эндогенных повреждающих факторов.
Созданный в качестве фармакологического препарата мелатонин обнаружил необычайно широкий диапазон лечебных возможностей, которые оказались востребованы при различных патологических состояниях головного мозга и внутренних органов. Многие из них (церебральный отек, поражения желудочно-кишечного тракта, болевой синдром и др.) неизменно сопровождает воспаление, ограничение которого могло бы служить одной из целей терапевтического воздействия мелатонина. Это обстоятельство побудило обобщить факты, свидетельствующие и наличии у мелатонина противовоспалительных свойств, а также изучить данные свойства в ходе эксперимента [3].
Противовоспалительные возможности мелатонина
Способность мелатонина ограничивать воспалительный процесс определяется, по-видимому, совокупностью механизмов, имеющих как регионарное, так и системное происхождение. К числу местных факторов можно отнести прямое влияние мелатонина на отдельные компоненты воспалительной реакции, изменение иммунной реактивности и ограничение оксидантного стресса.
Одним из важнейших элементов антиэкссудативного действия мелатонина следует признать его вмешательство в каскад арахидоновой кислоты с нарушением синтеза простагландинов. Этот факт был установлен в опытах in vitro еще в начале 80-х годов прошлого века. Уже тогда обращалось внимание, с одной стороны, на сходство ингибиторных эффектов мелатонина и индометацина, а с другой – на вероятность их реализации в мозговой ткани (медиобазальном гипоталамусе) крыс [3,4].
Позднее на модели провоцируемой липосахаридом гипертермии и активации макрофагов было показано, что противовоспалительная активность мелатонина не зависит от непосредственного влияния на простогландиновые рецепторы, но определяется угнетением функции фермента циклооксигеназы (ЦОГ), индуцибельная изоформа которой – ЦОГ-2, являясь ключевым этапом в биосинтезе простогландинов, играет, как известно, критическую роль в воспалительном ответе при разных формах патологии.
Синтез индольного соединения мелатонина в секреторных клетках шишковидной железы — пинеалоцитах — происходит в несколько этапов. Исходным звеном является триптофан, который через серотонин и N-ацетилсеротонин превращается в конечный гормон. Ключевыми ферментами синтеза являются N-ацетилтрансфераза и гидроксииндол-O-метилтрансфераза. Образующийся мелатонин секретируется главным образом в спинномозговой жидкости, из которой он попадает в сосудистое русло, а затем переносится по всему организму кровотоком. В структурах головного мозга и периферических органах действие гормона осуществляется через специфические рецепторы (в основном, типов MT1 и MT2) [5].
Показательно, что образование эпифизарного мелатонина, вне в зависимости от видовых особенностей животных, максимально выражено в темноте и минимально на свету. Это обстоятельство дает основание рассматривать шишковидную железу как важную хронотропную железу, которая благодаря тесным морфофункциональным связям с драйвером циркадного ритма — супрахтмическими ядрами гипоталамуса — циркадными колебаниями различных физиологических функций. Учитывая факт преобладающей секреции мелатонина в темноте, они стали приписывать непосредственный интерес формированию цикла сна-бодрствования. В результате мелатонин приобрел репутацию естественного организатора биологических ритмов — хронобиотика и природного гипногенного агента.
В 70-е годы минувшего века иммуногистохимическая техника позволила установить наличие наряду с эпифизарным собственного мелатонина в различных периферических тканях. Содержащие его, в большинстве своем энтерохромаффинные, клетки принадлежат к ряду апудоцитов и наиболее полно представлены в различных элементах желудочно-кишечного тракта [4].
Как и в эпифизе, внеэпифизарный мелатонин проходит аналогичные этапы синтеза при участии тех же ферментов. Знаменательно, что его общее количество в ткани этих органов в десятки раз превосходит уровень плазменного мелатонина эпифизарного происхождения. После удаления эпифиза исчезают суточные колебания содержания гормона в плазме крови, но за счет периферических клеточных элементов в дневные часы он продолжает в определенном количестве удерживаться в сосудистом русле.
Влияние мелатонина на воспалительный процесс
Существует ряд клинических и экспериментальных данных о влиянии мелатонина на различные патологические состояния, связанные с воспалением. Среди них воспалительные поражения суставов, внутренних органов (например, язвенный колит), периферических нервов. Следует сразу подчеркнуть, что такие факты не всегда однозначно указывают на клиническую эффективность препарата [3,5].
Прежде всего, по наблюдениям отдельных исследователей, повторное введение препаратов мелатонина пациентам с ревматоидным артритом может успешно дополнить базовую терапию и повысить ее эффективность. Так, при ежедневном применении (3 мг в сутки) описано более выраженное ослабление утренней скованности, уменьшение количества опухших и болезненных суставов. Клиническое улучшение коррелировало с нормализацией ночного сна и перестройкой ритма суточной секреции кортизола. При более высокой дозе (10 мг) мелатонин наряду с некоторым ограничением симптомов ревматоидного артрита значительно оптимизировал антиоксидантный статус у пациентов. Многочисленная информация также представлена ??о способности мелатонина (3-6 мг) снимать головные боли различного происхождения. У людей и животных мелатонин также ограничивал ототоксическое действие аминогликозидных антибиотиков, оптимизировал лечение пациентов с ожогами, а при длительном (6-12 месяцев) применении улучшал состояние пациентов с язвенным колитом. В то же время имеются данные о способности мелатонина в некоторых случаях обострять течение ревматоидного артрита у пациентов и при его экспериментальном моделировании на животных [5].
Учитывая преобладание информации, указывающей на ограничение воспалительных проявлений мелатонина, вводимого извне, следует признать, что важно искать связь между уровнем эндогенного мелатонина и выраженностью симптомов. Однако результаты этого поиска еще не дают однозначных выводов. Согласно одной информации, радиоиммунное определение уровня гормонов плазмы у пациентов с ревматоидным артритом в ночное время указывает на снижение его значения по сравнению со здоровыми людьми, и, согласно другим данным, ревматоидный артрит и анкилозирующий спондилит, напротив, сопровождаются, напротив, увеличение секреторной активности шишковидной железы. Однако есть указание на то, что при патологии, в отличие от нормы, кривая суточной выработки мелатонина выглядит иначе, поскольку пик его содержания в плазме смещается вперед на несколько часов. Однако защитный, адаптивный характер эпифизарной гиперактивности в ответ на первичное воспалительное поражение не исключен.
Цель исследования:
Определение противовоспалительной активности мелатонина на модели «каррагенинового» отека лапы у крыс.
Материалы и методы
Изучение противовоспалительной активности мелатонина проводили на модели «каррагениновый отёк лапы» у крыс. Эксперименты выполнены на 30 белых неинбредных крысах средней массой 325,97±1,2 г. Подопытных животных содержали в условиях вивария (с естественным режимом освещения; при температуре 22–24; относительной влажности воздуха 40–50 %) с использованием стандартной диеты (ГОСТ Р 50258-92). Исследования проводили в соответствии с правилами качественной лабораторной практики (GLP) при проведении доклинических исследований в РФ, а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1986).
Противовоспалительную активность мелатонина оценивали в экспериментах на модели «каррагенинового» отека лапы. Острую воспалительную реакцию (отек) воспроизводили субплантарным (под подошвенный или плантарный апоневроз) введением 0,1 мл 1% раствора каррагенина (сульфатированный полисахарид из ирландского морского мха) [2]. Выраженность воспалительной реакции оценивали через 3, 12 часов после индукции воспаления по изменению объема лапы (онкометрически). Исследуемые вещества наносили на лапы крыс в виде мази. Противовоспалительный эффект, оцениваемый по уменьшению отека, выражали в процентах по отношению к контролю.
В качестве исследуемого вещества был выбран мелатонин в составе двух препаратов: Мелатонин + L-теанин 200 мг (Производитель: Nature Made) и Мелаксен (Производитель: Юнифарм) . Исследуемые вещества наносили на лапы крыс в виде мази, изготовляемой непосредственно перед экспериментом путем добавления измельченных препаратов к мазевой основе (10% раствор Натрий –КМЦ). Препаратом сравнения был выбран Диклофенак– стандартное НПВС.
Подопытные животные были разделены на 4 группы (по 6 крыс в каждой):
1) Крысы, получавшие Мелатонин с теанином в дозе 10 мг/мл – 0,1 мл;
2) Крысы, получавшие Мелаксен в дозе 10 мг/мл – 0,1 мл;
3) Крысы, получавшие Диклофенак в дозе 10 мг/мл – 0,1 мл;
4) Крысы контрольной группы
Результаты
Было выявлено, что при субплантарном введении 0,1 мл 1 % раствора каррагенина у подопытных крыс развивается выраженный отек лапы, о чем свидетельствует достоверное увеличение ее объема. Отмечено, что максимальный отёк лапки (пик воспаления) развивался через 3 часа после введения каррагенина, при этом объем лапы у подопытных животных контрольной группы увеличивался в среднем на 82,5 %±5,7%.
При нанесении НПВС Диклофенака показатель прироста объема лапы составил 28,33±5,4% через 3 часа после индукции воспаления и нанесения препарата по сравнению с фоновым значением. При нанесении препаратов мелатонина это значение составило в среднем 52,08±7,7%. Также были найдены достоверные отличия между мелатонинсодержащими препаратами: прирост объема лапы крысы при применении Мелатонина с L-теанином составил 63,33±5,4%, Мелаксена – 40,83±9,9%.
При онкометрическом измерении объема лап крыс через 12 часов после индукции воспаления и нанесения препаратов достоверно наблюдалось уменьшение объема лап крыс по сравнению с измерениями через 3 часа после индукции воспаления: при нанесении Диклофенака на 15,33±2,4%; мелатонинсодержащих препаратов — на 23,33±5,6% в среднем. Причем показатели мелатонинсодержащих препаратов достоверно отличались между собой, при нанесении Мелатонина с L-теанином объем лап крыс уменьшился на 26,63±5,8%, при нанесении Мелаксена – на 20,03±5,3%.
Показатели объема лапы крыс в мл. (Таблица №1):
Название препарата | Объем лапы крысы, мл. | ||
Фон | Через 3 часа | Через 12 часов | |
Мелатонин+теанин | 0,96 | 1,59 | 1,33 |
Мелаксен | 0,92 | 1,33 | 1,13 |
Диклофенак | 0,98 | 1,27 | 1,08 |
Контрольная группа | 1,06 | 1,88 | 1,23 |
Таб.1 Объемы лап крыс
Прирост объема лапы крысы в процентном отношении (Таблица №2):
Название препарата | Прирост объема лапы крысы, % | |
Через 3 часа | Через 12 часов | |
Мелатонин+теанин | 63,33 | 36,70 |
Мелаксен | 40,83 | 20,80 |
Диклофенак | 28,33 | 13,00 |
Контрольная группа | 82,50 | 17,50 |
Таб.2 Прирост объема лапы в процентном отношении
Показатели объема лапы крыс в процентном отношении (Диаграмма №1):
